Inscription / Connexion Nouveau Sujet
Force de Lorentz
Bonjour s'il vous plaît j'ai besoin d'aide pour les deux derniers question
Exercice: Dans tout le problème, les dispositifs sont dans le vide; les vitesses sont faibles devant la célérité de la lumière. On ne tiendra pas compte de la pesanteur.
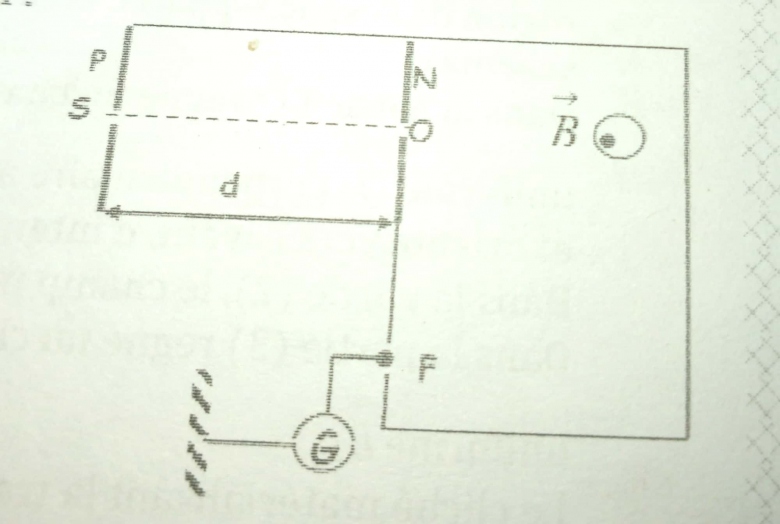
1) On considère deux plaques P et N, conductrices, parallèles, verticales et distantes de d = 10 cm. La tension entre ces plaques est U =V_{H} - V_{H} = 6.10^4 V .Une source émet des ions argent Ag+, avec une vitesse nulle, au travers d'une fente S placée dans la plaque P.
a) Quelle est la nature du mouvement des ions Ag+ entre les deux plaques?
b) Quelle est l'expression littérale de la vitesse des ions à leur arrivée arrivée en O, sur la plaque N?
c) L'argent est un mélange de deux isotopes 107Ag et 109Ag.
Calculer la vitesse de chacun des isotopes à son arrivée en O.
2) Les ions A g^ + traversent en O la plaque N par une fente et sont
alors soumis à un champ magnétique, de vecteur normal à leur trajectoire (voir ligure).
a) Montrer que la trajectoire de chaque ion est plane et préciser ce plan.
b) Montrer qu'ils sont animés d'un mouvement circulaire uniforme.
c) Etablir l'expression du rayon de courbure R en fonction de e, U, B et de la masse m d'un ion. Calculez R pour chaque type d'ion si B = 1T
3) A leur sortie du champ magnétique, les ions passent au travers d'une large fente et sont captés par un fil métallique F relié à la terre à travers un microampèremètre sensible G.
a) A quelles distances x de O faut-il placer le fil F pour recevoir respectivement les ions 107Ag+ et 109A g+ ?
b) Pour les distances x précédentes, le microampèremètre indique les courants respectif de 61,62 μA et 58,38 µA. Quelle est la composition isotopique de l'argent ?
Données : e = 1.6 * 0.1 ^ - 19 * C (107Ag)=107g.mol-1 :M(109 Ag)=109g mol-1; : N = 6.02 * 0.1 ^ 23 mol-1.
Bonsoir
Il y a des points communs avec l'exercice précédent, en particulier pour le début sur la différence de potentiels.
Explique ce que tu as fait et pose des questions précises sur ce qui te bloque.
Bonsoir aussi bon il se trouve que j'ai résolu pratiquement tous l'exercice mais je suis bloqué sur la question 3.a et 3.b dont je n'ai aucune réponse
Pourquoi la première on nous dit :A quelles distances x de O faut-il placer le fil F pour recevoir respectivement les ions 107Ag+ et 109A g+ ?
Calcule les rayons R1 et R2 correspondant aux deux isotopes de masses m1 et m2.
La distance OF vaut 2R1 pour un isotope et 2R2 pour l'autre isotope.
OK pour la question suivante ; Pour les distances x précédentes, le microampèremètre indique les courants respectif de 61,62 μA et 58,38 µA. Quelle est la composition isotopique de l'argent ?
Le micro ampèremètre enregistre des courants proportionnels au nombre d'ions captés par seconde. Le rapport des deux intensités est donc aussi le rapport des quantités des deux isotopes .
Je note x la quantité en mole d'isotope 107 présente dans une mole d'argent naturel et donc (1-x) la quantité en mole d'isotope 109 (x : inconnue comprise entre 0 et 1mole). La relation de proportionnalité évoquée dans mon message précédent permet d'écrire :
Cette relation permet de calculer x. Tu pourrais aussi retrouver la masse molaire de l'élément argent dans la nature mais cela ne semble pas demandé.
Je n'ai toujours pas compris, d'où vient cette relation et aussi le N n'est toujours pas utiliser alors qu'on la donné dans l'énoncé.
Je résume le début : c'est la même chose que dans le problème précédent.
Vitesse Vo des ions au point O, à leur sortie de l'accélérateur :
Rayon de trajectoire dans le champ magnétique :
Distance OF :
C'est maintenant qu'il faut connaître la notion d'isotope. Tu dois revoir ton cours sur le sujet et éventuellement t'aider de cette fiche.
![]()
L'élément argent possède deux isotopes dont les atomes ont même nombre d'électrons et même nombre de protons mais des nombres de neutrons différents. Ils ont donc des masses différentes. un ion Ag+ est un atome d'argent ayant perdu un électron. La masse d'un électron étant négligeable devant celle d'un noyau atomique, on peut considérer que la masse d'un ion Ag+ est pratiquement égale à celle d'un atome Ag. Par définition de la mole, les masses des ions argent de chaque isotopes sont :
Cela conduit à deux valeurs différentes de OF : OF1 et OF2. Pour la suite : voir mon message précédent...
Bonjour, bon j'ai fait des recherches pour la composition isotopique et donc j'utilise la formule suivante :
Avec la composition isotopique de l'élément étudié,
l'intensité du courant en
c'est l'écriture global mais pour notre cas on a
de même pour
,enfin je trouve respectivement 51,35%. Et 48,65%
On peut utiliser le nombre Avogadro pour calculer les masses des isotopes car on nous à donner les masses molaires mais j'ai utilisé la formule suivante où
est la masse de protons mais on peut utiliser
qui est l'unité de masse atomique aussi .