Inscription / Connexion Nouveau Sujet
fabrication d un savon
Bonjour
Énoncé :
Lors d une séance de travaux pratiques, ton groupe est désigné par le professeur pour fabriquer du savon.il met a votre disposition m=100 g d huile de table ,de la soude , de l éthanol et le matériel nécessaire. Étant membre du groupe ,tu es chargé de la rédaction
1/ écris la formule semi développée du triglycéride formé a partir de l acide palmitique de formule :CH3(CH2)14 COOH contenu dans l huile de table .
2
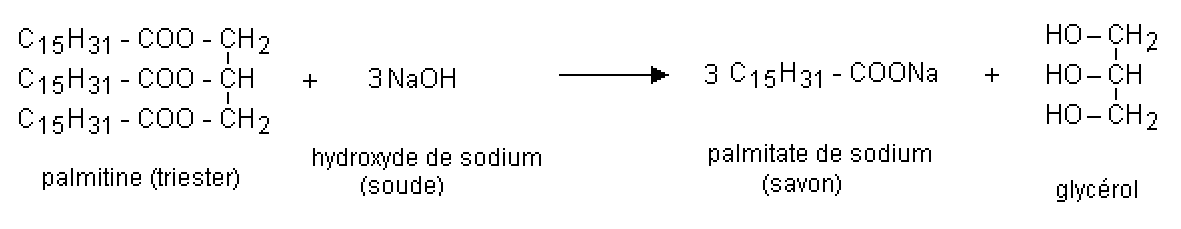
2/1 écris l équation bilan de la réaction de saponification du triester précédent par la soude
2/2 nomme les produits obtenus
3/ déterminer
3/1.la masse de savon obtenu
3/2.la masse de polyalcool obtenu
Réponse
Question 1
C5H31-COO-CH2
|
C5H31-COO-CH
|
C5H31-COO-CH2
.question 2/1
C5H31-COO-CH2
|
C5H31-COO-CH.
|
C5H31-COO-CH2
+ 3(NA^+ + OH^-) .
||
V
C5H31-COO^-,Na^+
C5H31-COO^- ,Na^+.
C5H31-COO^-,Na^+
+ HO-CH2
|
HO-CH
|
HO-CH
Question 2/2
Nomme les produits
On a le glycerol , et l autre , je n arrive pas a le nommer
Question 3/1
J ai besoin d aider
s ch
Question 1 et 2.1 :
* Les chaînes carbonées ne comptent pas 5 mais 15 atomes de carbone chacune.
* Il manque un atome d'hydrogène à la molécule de glycérol.
Cela mis à part tes réponses sont exactes.
Question 2.2 :
Le produit formé en même temps que le glycérol est un savon : Le palmitate de sodium.
Question 3 :
La méthode à suivre est exactement la même que pour n'importe quelle autre transformation chimique.
Tu auras besoin de calculer les masses molaires des réactifs et des produits.
Bonsoir
D après l équation bilan
n(triester)=n(savon)/3
n(savon)=3*n(triester)
n(triester)=m(triester)/M(triester)
m(triester)=100 g
M(triester)=(45*12+93+3*12+6*16+3*23)
M(triester)=770 g
n(triester)=100/770
n(triester)=0,13 mol
n(savon)=3*0,13
n(savon)=0,39 mol
m(savon)=n(savon)*M(savon)
M(savon)=(45*12+93+3*12+6*16+3*23)
M(savon)=834 g/mol
m(savon)=0,39*834
m(savon)=325,26 g
Pour ma part j'ai trouvé :
Pour le triester : C51H98O6 une masse molaire de (51*12) + (98 * 1) + (6 *16) = 806 g/mol
Pour le savon :C16H31O2Na
(16*12) + (31 * 1) + ( 2 * 16 ) + ( 1 * 23 ) = 278 g/mol
Ok
n(C51H98O6)=n(C16H31O2Na)/3.
n(C16H31O2Na)=3*n(C51H98O6)
Or n(C51H98O6)=100/806=0,12 mol
n(C16H31O2Na)=3*0,12
n(C16H31O2Na,)=0,36 mol
m(C16H31O2Na)=0,36*278
m(C16H31O2Na)=100,1 g
Je trouve un résultat différent de 3% et je suppose que cela provient des arrondis successifs mal maitrisés que tu emploies.
Soient nt, mt, Mt les quantités de matière, masse et masse molaire du triester.
Soient ns, ms, Ms les quantités de matière, masse et masse molaire du savon.
nt = mt / Mt
ns = 3 * nt = 3 * mt / Mt
ms = ns * Ms = 3 * Ms * mt / Mt
ms = 3 * 278 * 100 / 806 = 103g
Question 3/2
n(t)=n(glycerol)=mt/Mt
n(glycerol)=100/806=0,12 mol
M(glycerol)=3*12+3*16+8=92 g/mol
m(glycero)=n(glycerol)*M(glycerol)
m(glycerol)=0,12*92=11,04 g
Toujours tes erreurs d'arrondis.
Je trouve
mg = (mt/Mt)*Mg = (100/806) * 92 = 11,4g
Et si on utilise ta méthode de calcul en le faisant correctement :
n(glycerol)=100/806=0,124069 mol
m(glycerol)=0,124069*92=11,4143 qu'on arrondit à 11,4g
Le résultat final doit être arrondi.
Le (ou les) Les résultat(s) intermédiaires ne doivent pas être (trop) arrondis.