Inscription / Connexion Nouveau Sujet
Exo sur l'electrolyse
Bonjour à tous,
Comment allez-vous?
Mon professeur de physique-chimie m'a donne un exo à faire pour mercredi. J'air réussit a répondre aux 2 premieres questions, mais la derniere est un probleme.
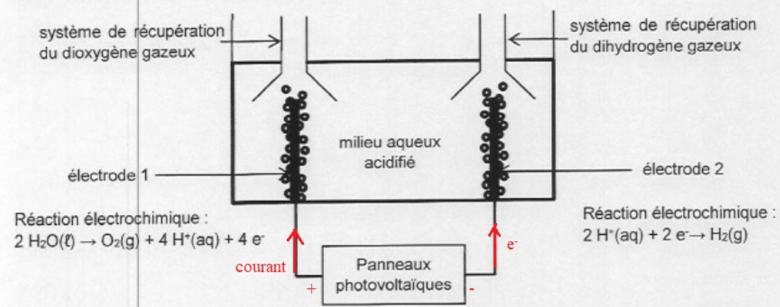
Pour les questions 1 et 2, j'ai uniquement du indiquer le sens des electrons et le sens du courrant dans le schema ci-contre.
Pouvez-vous m'aider pour la question 4 svp?
4) Le di-hydrogène produit par l'électrolyse, est stocké dans une citerne sous haute pression. On peut y stocker l'équivalent d'un volume de 1200 m3 de di-hydrogène H2 à 20°C sous une pression P = 1,013*105 Pa.
Calculer le temps nécessaire pour remplir complètement une citerne, initialement vide, avec du di-hydrogène H2.
Données :
Volume molaire d'un gaz à 20°C : Vm = 24 L*mol-1
La puissance électrique reçue par l'électrolyseur est P= 2,3*104 W.
La puissance électrique vaut : P= U * I.
La tension aux bornes de l'électrolyseur vaut U= 2,0 V.
L'intensité I=Q / t avec I en A ; Q en C et t en s.
1 Faraday =1 F = 9,65*104 C*mol-1
Bonsoir,
Pour démarrer :
Calculer (en moles) la quantité n(H2) de dihydrogène nécessaire pour remplir la citerne dans les conditions de température et de pression fixées par l'énoncé.
Si, ayant obtenu ce résultat, tu restes bloqué reviens te faire conseiller pour l'étape suivante.
J'ai reussit a calculer la quantité de n(H2) necessaire grace a l'equation des gazs parfaits. Le resulat que j'ai trouve est donc n(H2) = 5,0 * 104 mol.
J'ai deux questions à partir de maintenant :
1) Comment peut-on justifier l'emploi de l'equation PV = nRT (équation des gaz parfaits)? Est-ce un gaz parfait le H2?
2) Et ensuite, comment continuer pour l'etape suivante?
1) Tous les gaz peuvent être considérés comme parfaits pour peu que la pression ne soit pas trop élevée.
Mais l'utilisation de cette loi n'est pas indispensable ici puisque l'énoncé donne la valeur Vm du volume molaire des gaz dans les conditions de l'expérience.
On utilisera donc n(H2) = V(H2) / Vm
L'application numérique (qui n'est pas indispensable) donne bien:
n(H2) = 1200 / 24.10-3 = 5,0.104 mol
2) Connaissant n(H2) calculer (en mol) en utilisant la 1/2 équation d'oxydation la quantité n(e-) d'électrons qui ont circulé pour obtenir ce volume de dihydrogène.
Merci pour l'explication pour la quantite de matiere de H2,
Maintenant , pour calculer n(e-), je ne peut pas utiliser la formule QE = ne- * F, car je n'ai pas QE.
Je ne me souviens pas de l'autre methode pour calculer la quatite de matiere des electrons grace a la demi-equation... Pouvez-vous me la rappeller svp? Dois-je faire un tableau d'avancement pour trouver xmax?
En effet un tableau d'avancement pourrait être un outil utile.
Mais ici, le cas étudié est tellement simple qu'on peut se passer de cet outil.
La demi-équation concernée s'écrit :
2H+ + 2e- --> H2
On constate d'un simple coup d'il que pour former 1 mole de dihydrogène il doit circuler 2 moles d'électrons.
Donc n(e-) = 2 n(H2)
Donc n(e-) = 2 * V(H2) / Vm = 2 * 1200 / 24.10-3 = 1,0.105 mol
Ici encore le calcul numérique est facultatif
Je te laisse essayer de terminer seul.
En cas de difficulté n'hésite pas à revenir chercher de l'aide.
Ok donc maintenant qu'on a n(e-), on peut calculer la quantité d'électricité QE.
QE = ne- * F = 1,0 * 105 * 9,65 * 104 = 9,65 * 109 C
Ensuite,
I = P / U = 2,3 * 104 / 2 = 11 500 A
Et puis pour finir,
t = Q / I = (9,65 * 109) / 11 500 = 839 130 sec = 233h = 9,7 jours
Est-ce juste?


