Inscription / Connexion Nouveau Sujet
Exercice sur un tableau d'avancement
Bonjour,
je dois rendre un exercice de chimie dont l'énoncé est le suivant :
On chauffe du minerai de cuivre en présence de charbon de bois (carbone) pour obtenir du cuivre. L'équation chimique est :
2 CuO + C --> 2Cu + CO2
J'ai fait l'intégralité de l'exercice, je voudrais juste savoir si ce que j'ai fait est correct :
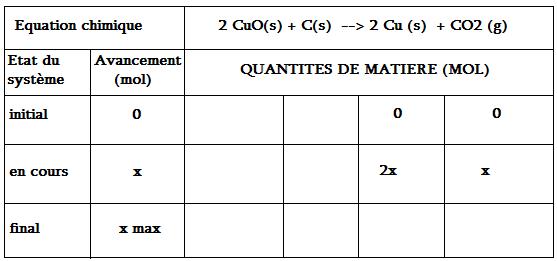
1 - Dresser un tableau d'avancement de cette transformation chimique
(voir le document joint n°1 (c'est le tableau que j'ai fait, recopié sous PAINT)
2 - Calculer les quantités de matières initiales minimales de réactifs pour obtenir 12,0 mol de cuivre solide
Là je suis vraiment pas sûr :
Puisque l'on a 2 CuO + C --> 2Cu + CO2, alors 12 CuO + 6 C --> 12 Cu + 6 CO2
3 - En déduire les masses minimales de réactifs à utiliser :
12 moles de CuO, et M(CuO) = 63,5 + 16 = 79,5 g/mol
Et : n = m/M <=> m = n.M = 12,0 + 79,5 = 954 g
6 moles de C, et M(C) = 12,0 g/mol
Et : n = m/M <=> m = n.M = 6,0 x 12,0 = 72,0 g
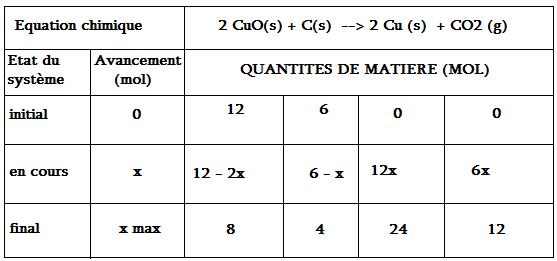
4 - En considérant les quantités de matières minimales des réactifs, réaliser un bilan de matière pour x = 2,00 mol et à l'état final.
(voir le document joint n°2)
8 mol de Cuo et 4 mol de C ont été consommés , et il est apparu 24 mol de Cu et 12 mol de CO2.
5 - Calculer la masse de cuivre formé à l'état final.
Il y a 24 mol de Cuivre. Et n = m/M <=> m = n.M = 24,0 x 63,5 = 1524 g (=1,524 kg)
Merci par avance pour votre aide.
Max.
Bonjour,
Pour la 2 , tu as raison de ne pas être très sûr...
Il faut trouver le réactif limitant. En principe, on veut utiliser tout le CuO donc c'est lui le réactif limitant ==> n0 - 2 xmax = 0 ==> n0 = 2 xmax.
Si on veut 12,0 mol de Cu, ça veut dire que 2 xmax = 12,0 ==> xmax = 6,0 mol.
Donc il faut 12,0 mol de CuO et 6,0 mol de C.
Pour la 3 ==> OK
La 4 et la 5, c'est faux...

Non, je ne trouve pas 12 CuO et 6 C. Je trouve 12 moles de CuO et 6 moles de C... ce qui n'est pas pareil...
Puisque l'on a 2 CuO + C --> 2Cu + CO2, alors 12 CuO + 6 C --> 12 Cu + 6 CO2
La partie surlignée en caractères gras n'est pas fausse à proprement parler (on multiplie l'équation par 6) mais ça ne sert à rien...


