Inscription / Connexion Nouveau Sujet
Exercice de dosage
Bonjour, voici l'exercice sur lequel je bloque depuis hier :
Dans une fiole jaugée de 500 mL, on verse 20 mL d'une solution d'acide chlorhydrique de concentration inconnue et on complete avec de l'eau distillé jusqu'au trait de jauge.
On prélève ensuite un volume Va=10mL de cette solution que l'on dose par une solution d'hydroxyde de sodium de concentration Cb = 0,20mol/L
La courbe donnant la conductance G de la solution en function du volume Vb de la solution d'hydroxyde de sodium verse est donné ci-après : cf image
Voici où j'en suis :
a) Au cours du dosage un réaction chimique à lieu entre le réactif titrant, l'hydroxyde de sodium NaOH et le réactif titré l'acide Chlorydrique HCl : (Na+)+(OH-)+(H+)+(Cl-)--> (Na+)+(Cl-)+H2O
b) J'ai fait un tableau que je n'arrive pas non plus à inserrer :
Avant équivalence : Na+ augmente, OH- est nul, H+ diminue et Cl- constant donc conductance diminue
Apres équivalence : Na+ augmente, OH- augmente, H+ est nul et Cl- constant donc conductance augmente
car ?(H+)>?(OH-)>?(Na+)
- OH- et H2O sont limitants
- On peut déterminer le volume à léquivalence lorsque la conductence augmente c'est à dire Véq = 15mL
Suis-je sur la bonne voie ? 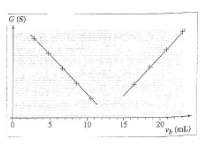
***Image recadrée --> un énoncé est à recopier***
Bonjour
Suis-je sur la bonne voie ?
Presque !
Le volume équivalent correspond au minimum de conductance de la cellule de mesure. Tu obtiens ce minimum en prolongeant les deux parties rectilignes. Le minimum correspond à l'intersection des deux segments ainsi obtenus. Ton scan est trop petits pour obtenir quelques chose de précis mais je pense que le volume équivalent est proche de 12,5mL.
Merci pour votre réponse !
En effet, je trouve 12,5 mL. Les autres réponses sont bonnes ?
Pour le tableau d'avancement de la question c) est ce que je peux simplifier la reaction en disant que Na et Cl sont spectateurs ce qui donnerait (OH-) +( H+ )--> H2O ?
Avant l'équivalence : compte tenu de la réaction, ajouter un ion Na+ et un ions HO- revient à ajouter dans la solution un ion Na+ et à faire disparaître un ion H+. Comme la conductivité molaire équivalence de H+ est nettement supérieure à celle de Na+, la conductivité de la solution diminue.
Après l'équivalence : ton raisonnement est correct.
Tu peux écrire l'équation bilan sous forme simplifiée à condition, quand tu raisonnes sur la conductivité, de tenir compte de la présence de tous les ions.
Merci beaucoup grâce à vous j'ai Presque finis ! juste une dernière question j'ai obtenu la concentration d'acide chlorhydrique grâce au tableau d'avancement j'ai trouvé C=2,5x10^-4 Mais il sagit de la concentration après la dilution non ? alors comment je vais pour trouver Co je multiplie par 50 ?


