Inscription / Connexion Nouveau Sujet
Exercice de Chimie : les pluies acides
Bonjour ! Mon prof m'a donné ce sujet et je ne sais pas comment le faire pouviez-vous m'aider ?
(C'est la première fois que je suis sur un forum donc je ne sais pas trop comment faire)
Voici le sujet
Exercice : Les pluies acides (10 points)
Doc.1 : Origine des pluies acides
Les « pluies acides » résultent de la présence dans l?air de dioxyde de soufre SO2 et d?oxydes d?azote. Ces gaz sont issus, entre autres, de différentes activités industrielles. Ils se dissolvent dans l?eau de l?atmosphère et forment des espèces qui acidifient les pluies.
Doc.2 : Protocole expérimental
En 60h, une centrale thermique rejette 10 m3 de gaz. La totalité de ce gaz est récupérée et mise à barboter dans 1 L d?eau : on obtient une solution S0 que l?on analyse. On place un volume V0 = 50mL de la solution S0 dans un erlenmeyer. On verse ensuite, une solution de concentration C1= 1 x 10?4 mol.L?1 en permanganate de potassium (K+ (aq) ; MnO4 ? (aq) ) jusqu?à changement de la coloration en rose, le volume de solution de permanganate de potassium alors versé est VE =10.8mL. L?équation de la réaction support du titrage s?écrit :
2 MnO4 ? (aq) + 5SO2 (aq) + 2 H2O (l) ? 2 Mn 2+ (aq) + 5 SO4 2? (aq) + 4 H + (aq)
Doc.3 : Normes de qualité de l?air relatives au dioxyde de soufre
Une directive concernant la qualité de l?air ambiant et un air pur pour l?Union européenne fixe des normes pour le dioxyde de soufre SO2.
- Seuil d?information et de recommandation : 300 ?g / m3 en moyenne sur 1 heure
Questions :
1. Identifier la solution titrante et la solution titrée. (1pt)
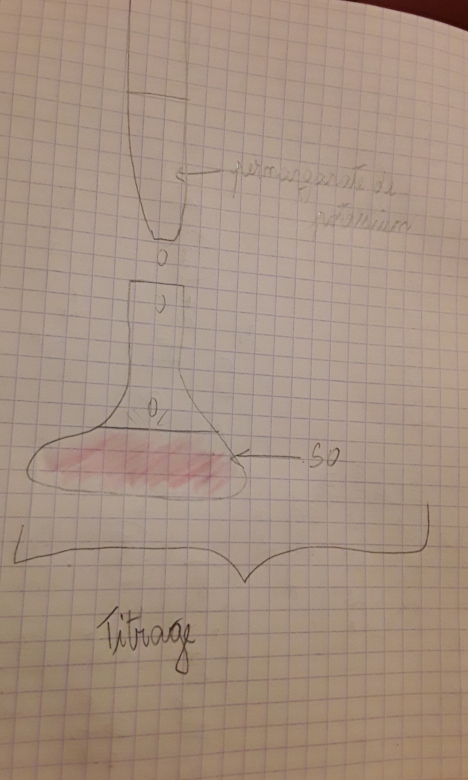
2. Schématiser et légender le dispositif de titrage. (2pts)
3. Comment repère-t-on visuellement l?équivalence du titrage colorimétrique ? (0.5pt)
4. Retrouver l?équation de la réaction à l?aide des couples oxydant/réducteur. (2.5pts)
5. Déterminer la concentration C0 en quantité de matière de dioxyde de soufre SO2 (aq) dans la solution S0. (1.5pts)
6. En faisant l?hypothèse que la totalité du dioxyde de soufre présent dans les effluents gazeux de la centrale thermique se dissout dans l?eau recueillie, calculer la concentration en masse de ces gaz SO2 dissous dans l?eau. (1pt)
7. Déduire si les concentrations des gaz rejetés par la centrale sont conformes aux normes de qualité de l?air. (1pt)
Données :
- Masses molaires atomiques:
? M (S) = 32 g.mol?1
? M (O) = 16 g.mo l?1
- Couple oxydant/réducteur :
? MnO4 ? (aq) / Mn 2+ (aq)
? SO4 2? (aq) / SO2 (aq)
***Titre complété***
Bonsoir ! Pouviez vous m'aidez pour cet exercice s'il vous plaît, je n'arrive pas à comprendre le sujet
Exercice : Les pluies acides (10 points)
Doc.1 : Origine des pluies acides
Les « pluies acides » résultent de la présence dans l'air de dioxyde de soufre SO2 et d'oxydes d'azote. Ces gaz sont issus, entre autres, de différentes activités industrielles. Ils se dissolvent dans l'eau de l'atmosphère et forment des espèces qui acidifient les pluies.
Doc.2 : Protocole expérimental
En 60h, une centrale thermique rejette 10 m3 de gaz. La totalité de ce gaz est récupérée et mise à barboter dans 1 L d'eau : on obtient une solution S0 que l'on analyse. On place un volume V0 = 50mL de la solution S0 dans un erlenmeyer. On verse ensuite, une solution de concentration C1= 1 x 10-4 mol.L-1 en permanganate de potassium (K+ (aq) ; MnO4 - (aq) ) jusqu'à changement de la coloration en rose, le volume de solution de permanganate de potassium alors versé est VE =10.8mL. L'équation de la réaction support du titrage s'écrit :
2 MnO4 - (aq) + 5SO2 (aq) + 2 H2O (l) 2 Mn 2+ (aq) + 5 SO4 2- (aq) + 4 H + (aq)
Doc.3 : Normes de qualité de l'air relatives au dioxyde de soufre
Une directive concernant la qualité de l'air ambiant et un air pur pour l'Union européenne fixe des normes pour le dioxyde de soufre SO2.
- Seuil d'information et de recommandation : 300 μg / m3 en moyenne sur 1 heure
Questions :
1. Identifier la solution titrante et la solution titrée. (1pt)
2. Schématiser et légender le dispositif de titrage. (2pts)
3. Comment repère-t-on visuellement l'équivalence du titrage colorimétrique ? (0.5pt)
4. Retrouver l'équation de la réaction à l'aide des couples oxydant/réducteur. (2.5pts)
5. Déterminer la concentration C0 en quantité de matière de dioxyde de soufre SO2 (aq) dans la solution S0. (1.5pts)
6. En faisant l'hypothèse que la totalité du dioxyde de soufre présent dans les effluents gazeux de la centrale thermique se dissout dans l'eau recueillie, calculer la concentration en masse de ces gaz SO2 dissous dans l'eau. (1pt)
7. Déduire si les concentrations des gaz rejetés par la centrale sont conformes aux normes de qualité de l'air. (1pt)
Données :
- Masses molaires atomiques:
M (S) = 32 g.mol-1
M (O) = 16 g.mo l-1
- Couple oxydant/réducteur :
MnO4 - (aq) / Mn 2+ (aq)
SO4 2- (aq) / SO2 (aq)
Je galère tellement ça me serai d'une grande aide si vous saviez comment faire merci 😊
*** message déplacé ***
Bonjour,
Si c'est un DM tu as très certainement pris le temps de réviser et de chercher les questions ?
Ce forum demande en effet que tu postes tes propositions. Tu as tout de disponible pour démarrer : fiches, utilitaires pour écrire une formule ...

1-la solution titrante : la solution S0 et la solution titré c'est la solution de permanganate de potassium
3- le changement de couleur
4- D'abord 2MnO4-(aq) +16H+ --> Mn2+(aq)+8H2O+1e-
Ensuite SO2+2H2O+1e- --> SO42-+4H+
Équation d'oxydoreduction c'est 2MnO4-(aq) +16H++SO2+2H2O -->Mn2+(aq)+8H2O+SO42-+4H+
Jusque là est ce que ça va ? Je suis pas sûre de mes réponses corrigez mes erreurs s'il vous plaît
(Désolé pour le multi-post)
Une fiche de cours qui pourrait t'aider : ![]() [lien]
[lien]
1. C'est faux, il suffit d'appliquer les définition du cours :
Extrait de la fiche :
* La solution titrante est une solution dont on connait la concentration molaire. On la verse dans la burette graduée.
* La solution titrée est une solution, diluée ou non, dont on ignore la concentration molaire. Son volume est mesuré avec la pipette jaugée : il est donc connu.
2. Où est le schéma du dispositif de dosage, c'est primordial pour synthétiser toutes les données importante de l'énoncé (s'inspirer de celui de la fiche).
3. TB
4. Ton équation n'est pas équilibrée : tu as deux atomes Mn côté réactifs et un seul côté produits => le principe de Lavoisier n'est donc pas respecté.

Donc 1- solution titrée : S0, solution titrante: permanganate de potatium
2-
4-D'abord MnO4-(aq) +8H+ --> Mn2+(aq)+4H2O+1e-
Ensuite SO2+2H2O+1e- --> SO42-+4H+
Équation d'oxydoreduction c'est MnO4-(aq) +8H++SO2+2H2O -->Mn2+(aq)+4H2O+SO42-+4H+
La c'est bon ?
Tu n'as pas lu la fiche fournie (clique sur la maison) : ![]() [lien]
[lien]
1. OK
2. Il manque des données de l'énoncé ... Inspire-toi de celui de la fiche !
3. Malheureusement ton équation n'est pas équilibrée en charge, tu as la première demi-équation abordée dans la fiche pour t'aider ...
Tu as également dans la section première une fiche sur les oxydoréductions si tu as un doute sur comment procéder.

Un résultat sans explications et sans unité c'est 0 le jour d'un examen ...
"Concentration en quantité de matière" ne veut strictement rien dire 
J'attends toujours le schéma du dispositif par ailleurs ...

Bonjour, je traite veux traité aussi le même sujet
4) Mn04-(aq)+8H+(aq)+5é "flèche" Mn2+(aq)+4H2O
SO2 + 2H2O "fléche" SO4²- +4H+ +2é
Bonjour,
Tu as des utilitaires pour faire des flèches proprement :
 extrait de
extrait de Q10 - Puis-je insérer des symboles mathématiques afin de faciliter la lecture de mon message ?
Sinon oui, tes demi-équations sont correctes car équilibrées en masse et en charge.

AH MERCI !!!
Pour le 5 les étapes
c'est pas n=CxVe
n = 1x1O^-4 x 10,8 x 10^-3 = 1,08 x 10^-06 mol
Puis C = n x V = 1,08 x 10^-06 mol x 50ml x 10^-3 =5,4x10^08 mol/L
Il faudrait que tu améliores ta qualité rédactionnelle car il faut expliquer ton raisonnement :
- expliquer ce que tu fais avec des phrases ;
- faire un calcul numérique (en définissant toutes les notations employées) ;
- finir par une application numérique ;
- et enfin conclure.

Je détermines la concentration molaire Co de dioxyde de soufre SO2 dans la solutio So
on cherches d'abord la quantité de matière de SO2
on a une équivalence donc, selon moi, n=CxVe
on a VE =10.8mL, C1= 1 x 10-4 mol.L-1
alors n = 1x1O^-4 x 10,8 x 10^-3 = 1,08 x 10^-06 mol
ensuite pour
la concentration
C = n x V
n = 1,08 x 10^-06 mol
V=50m
1,08 x 10^-06 mol x l x 10^-3 =5,4x10^08 mol/L
Donc C = 5,4x10^08 mol/L
C'est logique ou pas ? c'est vrai ou faux ?
Ce n'est pas correct, si tu te places à l'équivalence, as-tu lu attentivement la fiche fournie ?
Pour rappel : ![]() [lien]
[lien]
Après avoir écrit les deux demi-équation il faut écrire puis simplifier l'équation-bilan d'oxydoréduction de la réaction du dosage.
Ensuite, il faudrait idéalement faire un schéma du dispositif du dosage pour ne pas faire de bêtises.
Et appliquer la définition de l'équivalence :
"L'équivalence est atteinte quand les réactifs de la réaction du dosage ont été introduits dans des proportions stoechimétriques"
Où est la relation faisant intervenir les coefficients stoechiométriques des réactifs intervenant dans la réaction du dosage ?

AHHHH d'accord et si j'employais Co = (C1xVe/Vo) / (5/2)
donc Co = (1,08 x 10^-06 / 0,05L) / (5/2)
aors Co = 8,64x10^-06
Tu es sûr de ne pas avoir fait une erreur dans les conversions d'unité ?
Tes concentrations sont bien en mol/L et les deux volumes en L ?

L'ordre de grandeur est correct, je te fais confiance pour le calcul, le plus important étant d'expliquer proprement ta démarche avant de faire l'application numérique.

Avec plus de détails cette fois-ci car ça risque d'être compliqué de te répondre avec exactitude sinon (et l'affluence sur le forum est conséquente en fin de Toussaint ...)

6) La concentration massique de SO2 dissous dans l'eau
On cherche la quantité de matière de S02
V=1L et Vm = 24L/mol
n = V/Vm
= 1/24 mol (je grade la réponse exacte)
Je calcule la masse
m=nxM
M=32+16x2 = 64
m= 1/24 x 64 g
m = 2,6g
La Concentration massique
Cm = m/V
V= 10m3 = 10.000L
Cm= 2.6/10.000
= 2,6x10^-4g/L
7) 60h fait 2,6x10^-4g/L
1h fait combien ?
du coup j'ai fait 2,6x10^-4/60 = 4,3x10^-6g/L ou 4,3x10^micro g/L
Le raisonnement est correct pour les deux premiers calculs (même si j'aurais aimé un peu plus de phrases pour expliquer tout ça).
En revanche sur le dernier calcul, pourquoi considérer le volume en gaz ?

Oui mais quel volume faut-il considérer ?
Sortir des formules du cours ne suffit pas pour expliciter une démarche scientifique 
C'est ce que j'essaie de t'inculquer depuis le début de notre échange.

Doc.3 : Normes de qualité de l?air relatives au dioxyde de soufre
Une directive concernant la qualité de l?air ambiant et un air pur pour l?Union européenne fixe des normes pour le dioxyde de soufre SO2.
- Seuil d?information et de recommandation : 300 micro g / m3 en moyenne sur 1 heure
J'arrive pas à exploiter cette information
En fait, j'ai l'impression que tu as fait une erreur quelque part et je commence à être perdu par toutes ces formules :
1. Identifier la solution titrante et la solution titrée. (1pt)
* La solution titrante est une solution dont on connait la concentration molaire. On la verse dans la burette graduée --> solution S1 de permanganate de potassium (C1 ; Véq) ;
* La solution titrée est une solution, diluée ou non, dont on ignore la concentration molaire. Son volume est mesuré avec la pipette jaugée : il est donc connu --> solution dissoute S0 (C0, V0).
2. Schématiser et légender le dispositif de titrage. (2pts)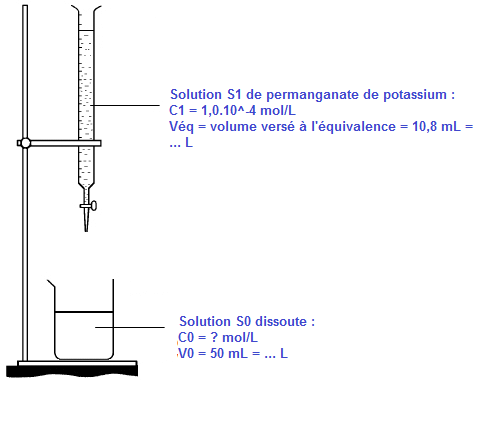
3. Comment repère-t-on visuellement l'équivalence du titrage colorimétrique ? (0.5pt)
La solution S0 est incolore à l'état initial. Au fur et à mesure que le permanganate de potassium va être versé, les ions permanganate vont réagir avec le dioxyde de souffre : la solution reste incolore. Puis lorsque tout le dioxyde de souffre a entièrement réagi, la première goutte de permanganate de potassium ajoutée va colorier la solution : on a atteint l'équivalence.
4. Retrouver l'équation de la réaction à l?aide des couples oxydant/réducteur. (2.5pts)
( MnO4-(aq) + 8H+(aq) + 5e- ==> Mn2+(aq) + 4H2O ) x2
( SO2 + 2H2O ==> SO42- +4H+ +2e- ) x 5
____________________________________________________________
2MnO4- + 16H+ + 10e- + 5SO2 + 10H2O ==> 2Mn2+ + 8H2O + 5SO42- + 20H+ + 10e-
qu'on simplifie :
2MnO4- + 5SO2 + 2H2O ==> 2Mn2+ + 5SO42- + 4H+
5. Déterminer la concentration C0 en quantité de matière de dioxyde de soufre SO2 (aq) dans la solution S0. (1.5pts)
L'équivalence est atteinte quand les réactifs de la réaction du dosage ont été introduits dans des proportions stoechiométriques :
6. En faisant l'hypothèse que la totalité du dioxyde de soufre présent dans les effluents gazeux de la centrale thermique se dissout dans l'eau recueillie, calculer la concentration en masse de ces gaz SO2 dissous dans l'eau. (1pt)
Par définition de la concentration massique :
avec calculée en question 5 et
soit
7. Déduire si les concentrations des gaz rejetés par la centrale sont conformes aux normes de qualité de l'air. (1pt)
Tu as donc une valeur fournie dans la norme pour 1h
Ta concentration massique calculée en question 6. est pour 60h
Conclusion ?


 guide latex
guide latex présent sous la zone de saisie du message. La liste complète des caractères mathématiques est disponible dans le
présent sous la zone de saisie du message. La liste complète des caractères mathématiques est disponible dans le  mode d'emploi du forum
mode d'emploi du forum
