Inscription / Connexion Nouveau Sujet
Exercice de chimie : cinétique
Bonjour,
J?ai mis ci-dessous une image de mon exercice. Pour trouver le temps de demi-réaction t1/2, je pense réaliser un tableau d?avancement afin de trouver xmax. Ensuite je le diviserai par 2 afin qu?il corresponde à mon temps de demi-réaction. Pour finalement le relier au volume V(H2).
Cependant je me trouve bloquer sur mon tableau d?avancement.
Merci d?avance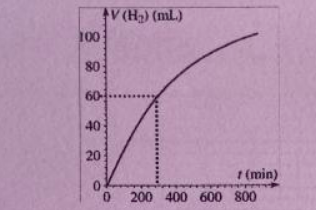
* mmalou > Image recadrée, sur la figure uniquement ! Si tu veux de l'aide, merci de faire l'effort de recopier ton énoncé sur le forum Lbuac  *
*
Bonjour
Le règlement du forum de mande de scanner les schémas, courbes et tableau mais de recopier l'énoncé.
Désolé c'est la première fois que je fais une demande, je vais supprimer ce post et en refaire un autre.
Merci
Bonjour,
Mon énoncé est le suivant:
« L?acide chlorhydrique H+(aq) + Cl-(aq), réagit sur l?aluminium selon une réaction totale qui fournit du dihydrogène et des ions aluminium (III) Al3+.
A l?instant t=0, on introduit une masse m= 0,80g d?aluminium en grenaille dans un ballon contenant V= 60,0mL d?une solution d?acide chlorhydrique de concentration c= 0,180 mol/L.
On recueille le gaz dihydrogène formé au cours du temps et on mesure son volume V(H2) : on obtient la courbe ci-contre.
Ma question est : déterminé le temps de demi-réaction t1/2 de ce système
Je compte réaliser en tableau d?avancement pour obtenir xmax. Ensuite je le divise par 2 pour le faire correspondre à t1/2. Pour finalement le relier au volume.
Cependant je suis bloquer au tableau d?avancement.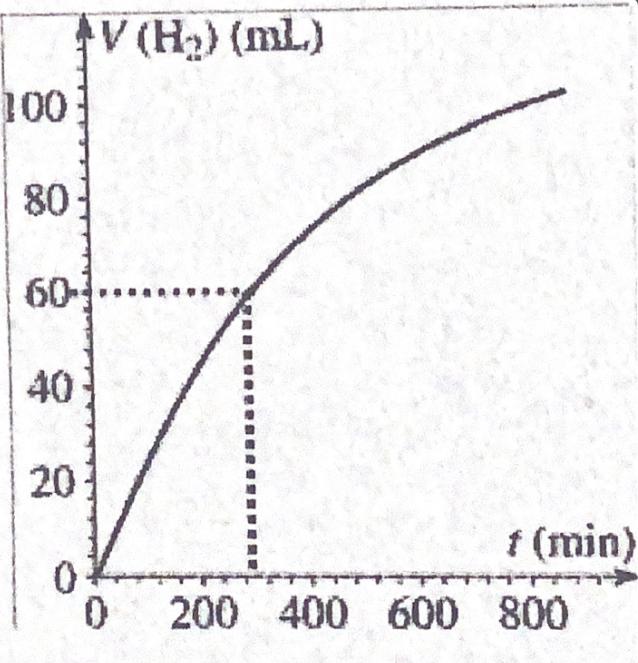

*** message déplacé ***multipost interdit***on répond dans son premier message quand il en est ainsi ***
La tableau d'avancement fourni ne correspond pas à la réaction étudiée ici. Connaissant la masse initiale d'aluminium et sa masse molaire, tu peux calculer la quantité initiale d'aluminium. Connaissant le volume et la concentration initiale de l'acide chlorhydrique, tu peux calculer la quantité initiale d'ions oxonium.
D'accord merci, je vais effectuer ces calculs. Donc si je comprend bien les deux quantités de matières préalablement données par mon professeur sont erronées. A la place il devrait y avoir des 0 non ?
Le tableau d'avancement que tu as scanné concerne la réaction de l'aluminium sur les ions zinc et il s'agit d'étudier la réaction de l'aluminium sur l'acide chlorhydrique ! Il faut réfléchir...
Merci beaucoup pour votre aide, maintenant que j'y vois plus clair pour le tableau d'avancement tout me semble plus simple, j'en déduis que mon professeur a dû nous donner un mauvais tableau.
OK.
Pour obtenir le volume de dihydrogène, il faudrait des indications sur le volume molaire de H2 . Soit ce volume molaire est fourni, soit l'énoncé fourni la température et la pression permettant de le calculer.
PS : je ne serait pas étonné que le volume maximum de dihydrogène, celui obtenu en fin de réaction, soit égal à 120mL. Il y a quand même des concepteurs d'exercices sympas avec les élèves ! 
Le volume molaire de H2 est fourni dans mon énoncé. Il est de 22,0 L/mol.
Grâce à mon tableau d'avancement j'ai trouver un xmax= 1,08x10-2 (je ne suis tout de même pas sûr de ce résultat). Notre professeur nous a confirmé que pour trouver t1/2 il faut mettre en relation xmax/2 avec notre graphique V(H2)=f(t).
J'ai donc trouvé xmax/2= 5,4x10-3, mais ce résultat ne me semble pas plossible
Je pense que, dans ton tableau d'avancement, tu gères mal le coefficient stchiométrique "2" devant H3O+ dans l'équation bilan.
Personnellement, j'obtiens xmax = 5,4.10-3mol (ne pas oublier l'unité) et une quantité maximale de dihydrogène égale à xmax , ce qui conduit bien au volume maximum prévu dans mon message de 17h59.
Si tu veux, tu peux scanner et poster ici ton tableau d'avancement (seulement ce tableau pour respecter le règlement du forum).
Je pense avoir très mal écrit mon équation, car en réactif j'ai simplement mit l'aluminium et l'acide chlorhydrique mais je n'ai pas mit d'ion. Désolé ça fait longtemps que je n'ai pas fait de tableau d'avancement je suis un peu perdu 😅
Il faut partir de l'équation bilan :
Zn +2 H3O+  Zn2+ + H2 + 2H2O
Zn2+ + H2 + 2H2O
| Espèces chimiques | Zn | H3O+ | Zn2+ | H2 | H2O |
| Quantités introduites (mmol) | 29,6 | 10,8 | 0 | 0 | excès |
| Quantités en cours de réaction | 29,6-x | 10,8-2x | x | x | excès |
| Quantités finales (mmol) | 29,6-xmax | 10,8-2xmax | xmax | xmax | excès |
L'épuisement du zinc correspondrait à xmax=29,6mmol ; l'épuisement des ions oxonium correspondrait à xmax=5,4mmol. Les ions oxonium constituent donc le réactif limitant. Il faut donc retenir :
xmax =5,4mmol (millimoles)
Si nécessaire : plus de détails sur les tableaux d'avancement ici :
Désolé : j'ai fait un mix entre ta réaction faisant intervenir le zinc et celle qui fait intervenir l'aluminium : oublie mon message de 19h18. Je corrige ! Désolé !
Je suis parvenu grâce à votre aide au même tableau d'avancement que vous merci beaucoup. Effectivement mon équation était erronée.
J'obtiens donc un xmax= 5,4x10-3 mol et comme vous l'avez dit dans un précédent message une quantité de matière maximale du dihydrogène égale au xmax.
Grâce au volume molaire de H2 je peux donc dire que le volume vaut 120mL. C'est donc à partir de là que je peux utiliser mon graphique pour obteniez mon t1/2. Celui-ci vaudra alors environ 295 minutes ?
Il faut partir de l'équation bilan :
2Al +6H3O+  2Al3+ + 3H2 + 6H2O
2Al3+ + 3H2 + 6H2O
| Espèces chimiques | Al | H3O+ | Al3+ | H2 | H2O |
| Quantités introduites (mmol) | 29,6 | 10,8 | 0 | 0 | excès |
| Quantités en cours de réaction (mmol) | 29,6-2x | 10,8-6x | 2x | 3x | excès |
| Quantités finales (mmol) | 29,6-2xmax | 10,8-6xmax | 2xmax | 3xmax | excès |
L'épuisement de l'aluminium correspondrait à xmax=14,8mmol ; l'épuisement des ions oxonium correspondrait à xmax=1,8mmol. Les ions oxonium constituent donc le réactif limitant. Il faut donc retenir :
xmax =1,8mmol (millimoles)
La quantité maximale de dihydrogène obtenue est ainsi : n=3xmax=5,4mmol.
Si nécessaire : plus de détails sur les tableaux d'avancement ici :
Puisque la quantité maximale de dihydrogène est limitée par l'acide chlorhydrique et non par le métal, remplacer le zinc par l'aluminium ne change pas la quantité de dihydrogène obtenue mais modifie fortement le tableau d'avancement !
D'accord avec la valeur de t1/2 aux incertitudes graphiques près.
Lorsque je pars de votre équation bilan j'arrive à résoudre entièrement mon exercice, merci beaucoup.
( Je n'ai plus qu'à fortement travailler comment trouver l'équation bilan. )
Je n'oublierais pas de préciser dans ma copie l'incertitude graphique pour la valeur de t1/2.
Encore merci de m'avoir accordé de votre temps pour m'aider.


