Inscription / Connexion Nouveau Sujet
Etude énergétique
Bonjour à tous,
J'ai un DM à faire pour demain dans lequel il y a trois parties et la dernière partie, je n'y comprend vraiment rien...
Est-ce que quelqu'un pourrait m'aider, cela est pour demain...Merci à tous d'avance pour votre aide car j'en ai vraiment besoin, sinon c'est la mauvaise note assurée...Coordialement
C.Etude énergétique.
Données: Lors de l'électrolyse d'une solution de soude caustique, c'est une réaction d'oxydo-réduction qui a lieu: la réaction chimique d'électrolyse est 2H2O = 2H2 + O2. Le gaz qui se forme à la cathode (borne reliée au - du générateur) est du dihydrogène.
Expérience complémentaire au bureau:
On place une éprouvette graduée sur chaque électrode afin de mesurer le volume de gaz formée par électrolyse menée à I=Cte pendent une durée ∆t déterminée.
On a relevé les valeurs suivantes: U (V) = 4.1V ; I (A) = 0.150A ; ∆t (min) = 15min ; Vcathode (ml) = 18.7mL ; Vm = 24L/mol
Questions:
1.a. Déterminer la quantité de matière nh du dihydrogène formé puis en déduire la quantité de matière ne d'eau transformée pendant la durée ∆t. Dans les conditions de l'expérience, le volume molaire est Vm=24 L/mol.
b. Ecrire les 2 demi-équations électroniques qui ont eu à chaque électrode, sachant qu'à l'anode a lieu une oxydation.
2. Sachant que pour transformer une mole d'eau en dihydrogène par électrolyse, il faut apporter une énergie de 280 kJ:
a. Calculer la valeur de l'énergie électrique totale We qui a été consommée par l'électrolyseur pendant la durée ∆t.
b. Calculer la valeur de l'énergie chimique Wch qui a été fournie par l'électrolyseur pendant la durée ∆t.
c. A quel transfert d'énergie correspond la différence We-Wch ?
3. Schématiser les transferts d'énergie qui ont lieu avec un électrolyseur, en précisant sous quelle forme est:
- l'énergie reçue?
- l'énergie utile fournie?
- et l'énergie perdue?
4. Définir, puis calculer le rendement de cet électrolyseur.
Pour ma part, j'ai seulement fait ce que j'ai réussi, mais pour le reste je rame...
1.a. n=V/Vm
n=0.0187/24
n=7.79*10-4 mol
Il manque la 2ème partie de la a
1.b. Je n'y ait rien compris
2.a J'ai seulement réussi à calculer la puissance mais cela ne nous sert à rien: P=We/t
P=280000/0.25
P=1 120 000 W = 1 120 kW = 1.12 MW
Je vous remercie à tous d'avance,c'est pour demain!coordialement
Bonjour,
Je suppose que la valeur de n que tu annonces est ce que ton énoncé appelle nH, quantité de matière du dihydrogène ; c'est correct.
Quelle est la quantité de matière d'eau ne transformée dans le même temps ?
Question 1b :
Il s'agit d'eau additionnée de soude caustique. Quels sont les cations qui se dirigent vers la cathode ? Quelle est la demi-équation à la cathode ?
Quelle est la demi-équation à l'anode ?

je ne comprend vraiment pas comment faire pour calculer ne...
Pour la question 1b:
H2O + NaOH = ???
2.a. We=P*∆t
We=U*I*∆t
We=4.1*0.150*0.25
We=0.154 J
Est-ce exact ?
2.b. 1mol=280 kJ
7.79*10-4 mol= 0.218 kj
Donc Wch=218 J
Ce résultat est-il juste?
2.c. Transfert d'énergie We-Wch
0.154-218=-217.846
Je ne comprend pas pourquoi ce résultat est négatif...
Pour les questions 3 et 4 je ne sait vraiment pas comment faire.
Merci,coordialement.
1a) Quantité d'eau transformée : pour répondre à cette question il faut toujours s'appuyer sur l'équation chimique
2 H2O = 2 H2 + O2
A chaque fois que 2 moles de dihydrogène sont produites c'est que 2 moles d'eau ont été transformées.
On connaît nH le nombre de moles de dihydrogène produites et recueillies. Quel est le nombre de moles d'eau transformées ne ?
1b) Ayant additionné l'eau avec de la soude caustique, la solution est devenue meilleure conductrice de l'électricité en particulier grâce à la présence des anions HO-. Ces anions vont se diriger vers l'anode pour y être oxydés :
4 HO- = O2 + 2 H2O + 4 e-
Dans le même temps se déroule une réaction de réduction à la cathode :
4 H2O + 4 e- = 2 H2 + 4 HO-
La réaction globale est bien :
2 H2O = 2 H2 + O2
2a) L'unité SI de temps est la seconde et non pas l'heure.
W = U.I. t
t
W en joules (J)
U en volts (V)
I en ampères (A)
 t en secondes (s)
t en secondes (s)
2b)
Oui, ce résultat est juste Wch = 218 J
Fais attention de bien écrire les unités : le kilojoule a pour symbole kJ
Donc cette énergie chimique s'écrivait aussi Wch = 0,218 kJ
2c)
Je ne comprend pas pourquoi ce résultat est négatif...
Dès que tu rencontres un tel problème (et c'est bien de l'avoir vu !) tu dois chercher une erreur ! Et tu aurais sans doute pu ainsi trouver ton erreur de la question 2a
3
Pour bien répondre à la question 3 il faut tout d'abord répondre à la question 2c : sous quelle forme est transformée l'énergie We - Wch ?
4
Cette question suit directement la question 3 : le rendement est le rapport de ce qui est utile (ici l'énergie chimique) à ce qui est dépensé (ici l'énergie fournie à l'électrolyseur)

1.a Nous avons 2 moles d' H2 produites et 7.79*10-4 moles d'H2 recueillies.
Si 2 moles d'H2 sont produites, c'est que 2 moles d'H2O sont recueillies.
Donc, je pense qu'en fesant un produit en croix  2*7.79*10-4)/2
2*7.79*10-4)/2
Par contre, cela est égal à 7.79*10-4 ce qui semble également faux...
Par contre, je ne vois pas d'où peut provenir cette erreur.
2.a. We=U*I*∆t 15min=15*60 sec = 900 secondes
We=4.1*0.150*900
We=553.5 J
Merci de m'avoir fait comprendre mon erreur 
2.c. We-Wch = 553.5 - 218
We-Wch=335.5 J
Et voila, j'ai maintenant compris pourquoi ce résultat était négatif!
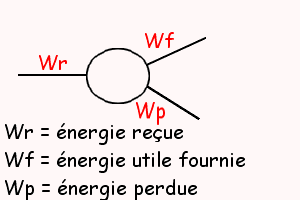
3.Voir le dessin...
4.Je ne comprend pas vraiment commment calculer le rendement.
Merci encore 
Il n'était peut-être pas nécessaire de faire un produit en croix ...
Il y a toujours (coefficients 2 pour H2O et pour H2) autant de moles de dihydrogène produites que de moles d'eau transformée.
Donc, réponse à la question 1a : nH = ne = 7,79.10-4 mol
2a : oui, c'est bon ! We = 553,5 J que l'on peut sans doute arrondir à 553 J
Merci de ta remarque. C'est bien mon but en aidant sur ce site. Non pas montrer, détecter, corriger les erreurs, mais faire comprendre...
2c : oui, 553,5 - 218,2 = 335,3 J que l'on peut aussi arrondir à 335 J
mais cette énergie est "perdue" sous quelle forme ?
Oui pour le dessin. Peut-être faut-il accompagner les symboles des valeurs calculées mais surtout, je crois, il faut indiquer la forme prise par l'énergie pour ces trois branches.
Quelles formes de l'énergie connais-tu ?
4 : le rendement
Simple quotient (souvent exprimé en pourcentage) de l'énergie utile divisée par l'énergie consommée (que tu as appelée dans ton dessin "énergie reçue", en effet c'est l'énergie reçue par l'électrolyseur)
Si je veux décomposer de l'eau pour disposer de dihydrogène et de dioxygène, ce qui m'intéresse (ce qui m'est utile) est cette énergie chimique à transmettre à l'eau. Je ne suis pas intéressé par l'énergie "perdue" (à moins d'en trouver un usage...).
Ce que cela me coûte est l'énergie électrique que je dois fournir à l'électrolyseur.
Le rendement me permet de savoir quelle part de l'énergie électrique me sera utile.
D'accord ?

2.c. Je pense que cette énergie est perdue par perte joules
3.Je connait l'énergie électrique, l'énergie thermique, et l'énergie musculaire. Donc, dans ce cas précis, je pense qu'il s'agit d'énergie électrique pour faire fonctionner l'électrolyseur.
4. Donc je pense que le rendement de cet électrolyseur n'est pas rentable, car la différence entre We et Wch est importante.

Oui, il y a une résistance au passage du courant dans l'électrolyseur qui conduit à la transformation d'une partie de l'énergie électrique en énergie thermique (effet Joule). Comme le but de l'électrolyseur n'est pas de chauffer la pièce dans laquelle il est installé on dit que cette énergie est "perdue" ; "pertes" par effet Joule.
Pour la question 3 :
Wr = 553 joules, énergie fournie sous forme d'énergie électrique à l'électrolyseur qui la "reçoit"
Wf = 218 joules, énergie recherchée, "utile", sous forme d'énergie chimique capable de décomposer l'eau en dihydrogène et dioxygène
Wp = 335 joules, énergie perdue sous forme d'énergie thermique, de chaleur ; ce sont les pertes par effet Joule
Le rendement de cet électrolyseur est donc
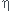 = Wf / Wr = 218 / 553 = 0,394
= Wf / Wr = 218 / 553 = 0,394
on exprime habituellement un rendement en pourcentage, donc
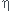 = 39,4 %
= 39,4 %
Ceci signifie que 39 % de l'énergie "fournie" à l'électrolyseur est effectivement convertie sous la forme d'énergie souhaitée et donc aussi que 61 % de l'énergie fournie est transformée en une forme d'énergie qui n'est pas recherchée.

Merci beaucoup, grâce à toi je pense avoir compris!
Merci aussi d'avoir donner tout ce temps pour m'expliquer.A bientôt, coordialement.


