Inscription / Connexion Nouveau Sujet
Etude de la pile cuivre-plomb
Bonsoir,
Je suis bloquée sur un DM traitant de l'étude de la pile cuivre-plomb.
Énoncé : On souhaite réaliser la pile suivante. Le compartiment de droite de la pile est constitué d'une électrode de cuivre (Cu solide) plongeant dans une solution contenant des ions Cu2+. Le compartiment de gauche est constitué d'une électrode de plomb (Pb solide), plongeant dans une solution contenant Pb2+. L'électrode de cuivre est pôle + de la pile.
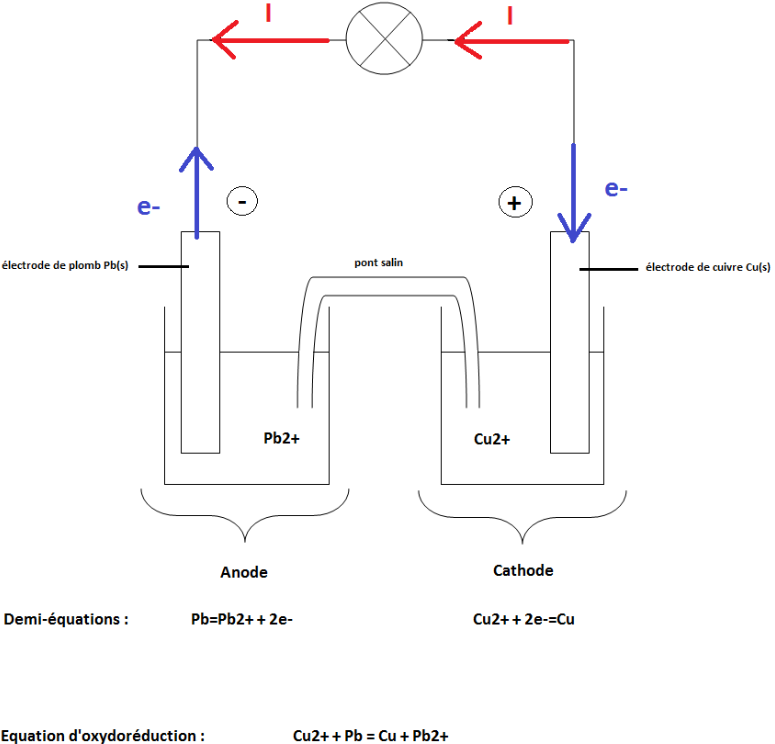
1. Faire un schéma de la pile décrite ci-dessus. Placer le sens de déplacement du courant, le sens de déplacement des électrons, l'anode, la cathode et écrire sous chaque compartiment la demi équation rédox se produisant.
2. Écrire l'équation de la réaction d'oxydoréduction de fonctionnement de la pile.
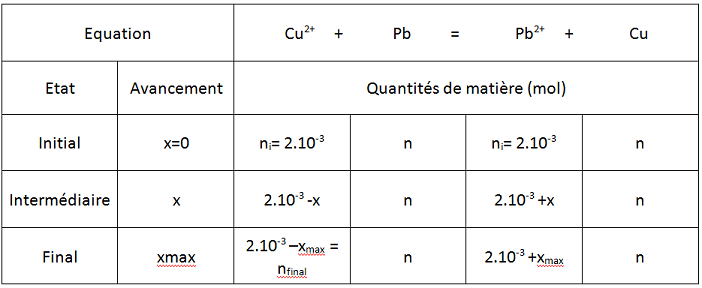
(voir schéma)
Les deux compartiments contiennent chacun 200 mL de solution de concentration 1,0.10-2 mol.L-1 en cations. On fait débiter la pile jusqu'à ce que la concentration à l'électrode de cuivre soit de 2,5.10-3 mol.L-1 en Cu2+.
3. Quel est l'avancement de la réaction d'oxydoréduction associée à cette pile à ce moment ?
Réponse :
(voir tableau)
- ni(Cu2+) = ni(Pb2+) = C*V = 1.10-2 * 2.10-1 = 2*10-3 mol.
- nfinal(Cu2+) = C*V = 2,5.10-3 * 2.10-1 = 5.10-4
donc xmax= 2.10-3 - 5.10-4 = 1,5.10-3 mol.
et nPb2+ = 2.10-3 + 1,5.10-3 = 3,5.10-3 mol.
La pile est-elle usée ? --> ça je ne sais pas comment faire !!
4. Quelle est la masse perdue par l'électrode de plomb ?
5. Quelle est la concentration finale de la solution de Pb2+ ?
Et ces deux questions-là je n'y arrive pas non plus...
Merci d'avance !! 
Énoncé : On souhaite réaliser la pile suivante. Le compartiment de droite de la pile est constitué d'une électrode de cuivre (Cu solide) plongeant dans une solution contenant des ions Cu2+. Le compartiment de gauche est constitué d'une électrode de plomb (Pb solide), plongeant dans une solution contenant Pb2+. L'électrode de cuivre est pôle + de la pile.
1. Faire un schéma de la pile décrite ci-dessus. Placer le sens de déplacement du courant, le sens de déplacement des électrons, l'anode, la cathode et écrire sous chaque compartiment la demi équation rédox se produisant.
--------------
Enoncé manquant de rigueur. Son auteur aurait écrire :
Placer le sens de déplacement du courant, le sens de déplacement des électrons, l'anode, la cathode et écrire sous chaque compartiment la réaction électrochimique se produisant lorsque la pile fonctionne en générateur.
--------------
2. Écrire l'équation de la réaction d'oxydoréduction de fonctionnement de la pile.
(voir schéma)
-------------
Pb(s)+Cu^(2+)(aq) = Pb^(2+)(aq)+Cu(s)
-------------
Les deux compartiments contiennent chacun 200 mL de solution de concentration 1,0.10-2 mol.L-1 en cations. On fait débiter la pile jusqu'à ce que la concentration à l'électrode de cuivre soit de 2,5.10-3 mol.L-1 en Cu2+.
3. Quel est l'avancement de la réaction d'oxydoréduction associée à cette pile à ce moment ?
Réponse :
-------------
Tableau d'avancement :
…………Pb(s)+Cu^(2+)(aq) = Pb^(2+)(aq)+Cu(s)
t=0……(a)……….(b)……………….( c)……………(d)
t……….(a-x)….(b-x)……………..(c+x)………(d+x)
où a=m(Pb)/M(Mb) est le nombre de mole initial correspondant à l'électrode en plomb, b=[Cu^(2+)]*V(Cu^2+)=1,0.10^(-2) *0.2=2*10^(-3) mol le nombre de moles initial d'ion cuivre(II) présents dans ce compartiment contentant l'électrode de cuivre, c=[Pb^(2+)]*V(Pb^(2+))==1,0.10^(-2) *0.2=2*10^(-3) mol le nombre de moles initial d'ion plomb(II) présents dans ce compartiment contentant l'électrode de plomb, et c=m(Cu)/M(Cu) est le nombre de mole initial correspondant à l'électrode en cuivre. x est l'avancement de la réaction.
-------------
La pile est-elle usée ?
--------------
Enoncé manquant de rigueur. Son auteur aurait écrire :
On suppose que a>b autrement dit que l'ion Cu^(2+) est l'espèce limitante lorsque la pile fonctionne en générateur.
Dans ce cas la réponse est : tant que [Cu^(+)]≠0 la pile n'est pas usée
--------------
4. Quelle est la masse perdue par l'électrode de plomb ?
--------------
b-x= 0.2*2,5.10^(-3) =0.5 10^(-3) mol ==> x=1.5*10^(-3) mol ==> m(Pb)=x*M(Pb)=1.5*10^(-3)*206=0.309 g
--------------
5. Quelle est la concentration finale de la solution de Pb2+ ?
--------------
n(Pb^(2+)=c+x=2.5*10^(-3)/0.2=1.25*10^(-2) mol/L
--------------
On fait débiter la pile jusqu'à ce que la concentration à l'électrode de cuivre soit de 2,5.10-3 mol.L-1 en Cu2+.
-------------------
ce qui veut dire que le nombre de moles d'ion cuivre dans le compartiment qui contient l'électrode de cuivre vaut :
b-x= 0.2*2,5.10^(-3) =0.5 10^(-3) mol
le nombre de moles d'ion cuivre x qui a été consommé vaut donc
x=b-0.5*10^(-3)= 2*10^(-3)-0.5.10^(-3) =1.5 10^(-3) mol
c'est aussi le nombre de moles de plomb consommées et la masse perdue par l'électrode de plomb vaut donc m(Pb)=x*M(Pb)=1.5*10^(-3)*206=0.309 g
oui une étape intermédiaire à disparue dans ce qua j'ai écrit il faut lire
n(Pb^(2+)=c+x=2.5*10^(-3)
[Pb^2+]=n(Pb^2)/V= 2.5*10^(-3)/0.2=1.25*10^(-2) mol/L