Inscription / Connexion Nouveau Sujet
Estérification et quotient de réaction
Bonjour tout le monde ! Je suis en train de faire mon DM de chimie à rendre pour la rentrée, et je sèche un peu sur certaines questions, c'est pourquoi votre aide me serait bien précieuse !
Voici l'énoncé :
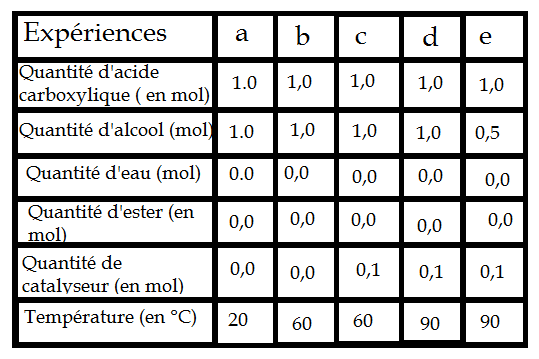
En utilisant à chaque fois le même acide carboxylique et le même alcool, on réalise une série d'estérifications avec des conditions expérimentales différentes, figurant dans le tableau ci-dessous. La constante d'équilibre associée à l'équation de cette réaction d'estérification est K=4.
a. Donner l'expression du quotient de réaction Qr à l'aide des concentrations des espèces chimiques mises en jeu dans cette réaction. Pourquoi, dans ce cas, peut-on également écrire Qr à l'aide des quantités de matière ?
b. Calculer Qr i pour les cinq expériences. Pourquoi peut-on affirmer que totues les transformations vont produire de l'ester ?
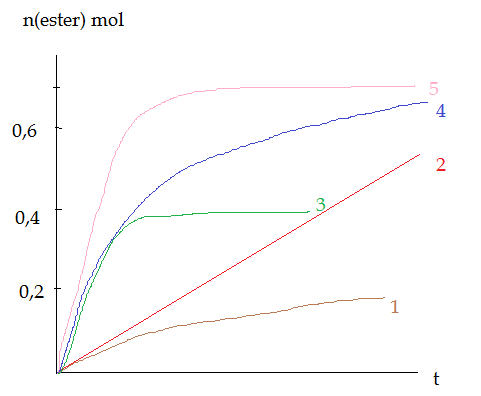
c. Associer à chaque graphe n(ester) = f(t) avec son expérience en justifiant la réponse. Quelle est l'équation mathématique de l'asymptote de chaque courbe 1, 2 et 4 ?
d. Calculer le taux d'avancement final pour chaque cas et vérifier pour chaque expérience que la valeur de Qr f tend effectivement vers K.
Pour la question a, j'ai dit : Qr = )[ester] * [H2O]) / ([Acide] * [Alcool]), donc en supprimant tous les V dans l'expression, on obitent effectivement le quotient de réaction avec les quantités de matières n dans l'expression seulement.
D'où : (n ester*nH2O)/( n acide*nalcool)
b. Dans chaque expérience, j'obtiens Qri = 0, donc Qri< K, donc il va effectivement se produire de l'ester. Mais je ne sais aps trop comment l'expliquer :s
Pour les deux autres questions, je sèche un peu :s Au vu du tableau, je voulais dire que l'expérience e correspondait à la courbe 1, soit celle qui produit le moins d'ester (car on remarque que la quantité d'alcool dans l'expérience e est la plus faible). Pour la a, je voulais dire qu'il s'agissait de l'expérience la plus lente, car sans catalyseur et avec la température la plus faible. Je pensais donc dire qu'il s'agissait de la courbe 2. Ensuite, c est moins rapide que d mais plus rapdie que b, donc je pensais : c = 5
d = 3
b = 4 mais je ne suis vraiment pas sure :s
Pour ce qui est des asymptote, je pensais que celle de la courbe 4 était y=0.7, mais je sèche vraiment là :s
Merci d'avance pour votre aide ! 
Edit Coll : images recadrées
bonjour,
a/OK
b)si Q<0 la réaction évolue dans le sens direct .(sens gauche droite)
en effet Q doit augmenter pour tendre vers K.Pour ce faire la concentration en produits (numérateur) doit augmenter ce qui est lié à une diminution de la concentration en réactifs (dénominateur).
c)
il faut distinguer les cas abcd du cas e
cas e ,le réactif limitant est l'alcool.L'état final tend vers une qté inférieure à 0,5 mol.(graphique 3 )
dans les autre cas ,la qté finale doit être la même.Cependant ,cette qté sera atteinte plus ou moins rapidement selon les facteurs cinétiques.
je te laisse revoir le choix des graphiques.
Il n' y a (a mon avis) que les graphiques 5 et 3 qui permettent d'écrire l'équation des l'asymptotes. Théoriquement n= 0,66 et n=0,42
Sur ton graphique on a n=0,7 et n=0,4
Les autres courbes n'ont pas atteintes le stade asymptotique.
Merci beaucoup pour ta réponse si rapide coriolan !
Ok, donc si e correspond à la courbe 3, je dirais que a correspond à la 1, b à la 2, c à la 4 et d à la 5, c'est bien ça ? 
Pour ce qui est des asymptotes, ça me pose vraiment problème car je ne trouvais d'asymptote que pour les courbes 5, 4 et 3 justement :s
Et pour la dernière question, tu aurais une idée ? 
pour l'ordre des courbes ,je suis d'accord.
pour la 3 et la 5 ,on voit nettement un palier presque horizontal .L'asymptote est la droite horizontale vers laquelle tend ce palier.
Pour les autres courbes ,la durée n'est pas suffisantes pour voir ce palier.On ne peut donc pas trouver graphiquement d'asymptote.
pour retrouver une valeur de K voisine de 4 ,il faut faire un tableau d'avancement
dans le cas 3 par exemple ,à l'état final
n(alcool)=0,5-0,4=0,1 mol
n(acide)=1,0-0,4=0,6 mol
n(ester)=n(eau)=0,4
K=0,42/(0,1*0,6)=2,7 ce n'est pas 4 car la détermination graphique est imprécise .Avec n(ester)=0,42 c'est déjà mieux .on trouve 3,8
dans le cas 5 ,avec n(ester)= 0,7 on trouve k= 5,4 On peut considérer que c'est une valeur proche de 4.
si on prend n(ester)=0,66 on trouve K=4
Merci beaucoup coriolan ! Par contre, si je comprends bien pour le cas 3 et 5, comment déterminer l'état final des 3 autres courbes ? :s
Surtout pour la courbe 2 en fait, la 1 et la 4 on pourrait déterminer, bien que de manière approximative, l'état final.
Je relis mon message et je me rends compte qu'il n'est pas très compréhensible, alors je recommence, désolée ! xD En fait c'est surtotu la 2 qui me poserait problème : pour la 1 et la 4, on peut trouver approximativement l'état final :p
comme je l'ai écrit,le graphique ne permet de déterminer que l'état final des cas 5 et 3.
dans l'énoncé on demande une équation de l'asymptote dans les cas 1,2,4,
La réponse attendue est sans doute de dire que
les mélanges alcool+ acide 1,2,4,5 étant identiques,leur état final sera le même.Seule la durée nécessaire pour atteindre cet état sera différente.(durée qui dépend de la température et de la présence éventuelle de catalyseur).
Comme graphiquement on peut tracer l'asymptote dans le cas 5,on en déduit que dans les cas 1,2,4 l'asymptote est la même. Equation y= O,7
(Théoriquement 0,66 mol d'ester )


