Inscription / Connexion Nouveau Sujet
Equation de préparation
Bonjour, je suis en train d'étudier le chapitre sur les hydroxydes.
J'ai un exercice dont l'énoncé est
" Écrivez l'équation de préparation de l'hydroxyde de lithium à partir du métal"
j'ai joint en image le corrigé. En fait je ne comprends pas comment je suis censée déterminer le coefficient "2" à côté de H20 et celui à côté de LiOH.
merci d'avance
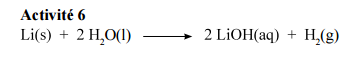
Oui donc je me doutais que c'était une question de pondération mais alors du coup à gauche on a 1 Li et à droite on se retrouve avec 2 Li ? 
"Rien ne se perd, rien ne se créé, tout se transforme".
Autrement dit, il y a conservation de la matière dans une réaction chimique, soit autant d'atomes côté réactifs que côtés produits :

Côté réactifs :
1 atome de Li
2*2 = 4 atomes de H
2 atomes de O
Côté produits :
2 atomes de Li
2 atomes de O
2+2 = 4 atomes de H
Effectivement, la réaction n'est pas équilibrée en l'état.

D'accord donc elle n'est pas équilibrée ! Mais alors j'ai juste une dernière question , sans accès à mon corrigé comment je suis censé les déterminer si la réaction n'est pas équilibrée ?
C'est inquiétant que tu me poses cette question en seconde, en principe tu es censé avoir appris à équilibrer une équation-bilan depuis le collège  ...
...
Voici un lien vers un topic dans lequel j'avais détaillé la méthode sur un exemple :
Clique sur la maison :![]() revision breve
revision breve
(message du 24-08-10 à 10:24)
En fait peut être que j'ai mal posé ma question , je comprends comment on équilibre une réaction, mais ce que je ne saisis pas c'est pourquoi le corrigé donne une équation non équilibrée.. :/


