Inscription / Connexion Nouveau Sujet
electrons manquants , electrons non liant en doublet
Bonsoir , il y a quelque chose que je ne comprends pas dans la correction , pouvez m'aider svp :
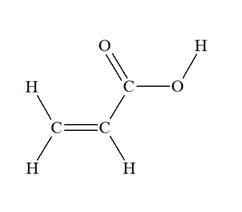
question : pour chaque atome verifier si ils respectent la regle de l'octet et du duet , apparier les elctrons non liants en doblets . Les placer sur les atomes en s'assurant que ces derniers respectent la regle de l'octet ou du duet :
H : z = 1 C : z = 6 O : z = 8
donc pour le H il manque bien un electrons pour avoir la regle du duet , pour le C , il en manque 4 et pour le O , il en manque 2 , pourquoi alors n'apparions nous les electrons non liants en doublets , que pour les O ???
Merci
bonjour,
je ne comprends bien pas ta question.
Un tiret entre atomes est un doublet d'électrons partagés .
A partir de H il y a un tiret: la règle du duet est satisfaite
A partir des C il y a 4 tirets : la règle de l'octet est satisfaite
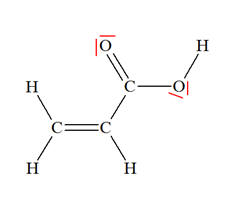
à partir de O il y a 2 tirets. Il manque 2 doublets pour satisfaire la règle de l'octet.Ce sont les doublets non liants en rouge.
L'atome "O" a 6 électrons sur sa couche externe .
Il met en commun avec C un électron et avec H un électron .( H et C apportent chacun un électron.)
Il reste donc 4 électrons autour de l'atome de "O" qui ne participent à aucune liaisons.Ce sont 2 doublets non liants.


