Inscription / Connexion Nouveau Sujet
doublets non liants
bonjour a tous,
il y a quelque chose que je n'aie pas compris dans mon cours, pour déterminer les doublets liants et les doublets non liants...
Je prends l'ex du carbone C Z=6 , (K)² (K)4 donc j'ai quatre électrons sur la couche externe, donc 4 doublets liants mais par exemple comment je fais pour déterminer les doublets non liants?
merci d'avance.
Bonjour.
Le carbone a 4 électrons sur sa couche externe, et donc pour respecter la règle de l'octet, ce sont 4 doublets non liants.
Autre exemple, l'oxygène O (Z=8)
Sa structure est (K)²(L)^6, soit 6 électrons sur la couche externe. Pour qu'il respecte la règle de l'octet, il va avoir 2 doublets non liants et 2 doublets liants.
Bonjour,
Pourquoi as-tu voulu rectifié le carbone? Il était bon 
Z=6, tu répartis:
Le max d'électrons sur la 1ere couche est de 2, ici tu peux les mettre. Or 6-2 = 4
Le max d'électrons sur la 2eme couche est de 8, ici il ne t'en faut que 4 et ça rentre!
Donc: (K)² (L)^4 
Pour répondre à ta question...
Les doublets liants sont ceux que tu vas dessiner sur ton papier si tu veux faire simple. Et les non liants sont ceux qui vont tourner autour de l'atome et être là au cas où il y aurait besoin. En gros, c'est ça, en très simple ^^
Maintenant si tu veux trouver le nombre de liaisons, tu vas soustraire le maximum d'électrons présents sur la dernière couche d'un atome en général, au nombre d'électrons sur la dernière couche de ton atome.
Oui, c'est pas forcément clair... Voici l'exemple avec le Carbone:
Z=6 et (K)² (L)^4
Ta dernière couche est la couche "L" dont le max d'électrons possible est de 8. Donc 8 - 4 = 4 liaisons. Tu vois le truc?
Avec l'Oxygène si tu veux:
Z=8 (K)² (L)^6
Dernière couche "L" d'où 8 - 6 = 2 liaisons! 
Concernant les non liants, tu en as à partir du moment où l'atome a plus de 4 électrons autour de lui.
Il existe une astuce suffisante en 1ere S.
Prenons l'exemple du Chlore: Z = 7 électrons. Tu les dessines autour de lui comme ceci (voir image)
En fait tu dessines tes électrons 1 à 1. Le 1er en haut, le 2e à droite, le 3e en bas, le 4e à gauche puis le 5e en haut et etc. Tu fais le tour comme ça. Tu te rendras compte que des paires se forment petit à petit, ces paires sont les doublets non liants et les électrons seuls vont former une liaison avec un autre atome!
Si je n'ai pas été claire sur certains points n'hésite pas à me dire 
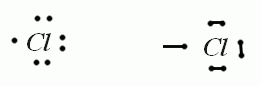
D'accord merci WilliamM007, j'ai essayé avec d'autres atomes et l'azote me pose problème,
N Z=7 (K)² (L)^5, donc je reprends ce que vous avez dit donc il y aura 3 doublets liants et 3 doublets non liants?
mais normalement c'est 1 doublets non liants
enfin j'ai remarqué que le nombre possible de doublets liants était de 4 donc je cherche juste à savoir combien y'a t'il de doublets liants et j'en déduis les non liants c'est juste aussi de penser ça ?
Salut  !
!
Une méthode systématique complémentaire :
Écris le nom et la formule brute de la molécule.
Écris la structure électronique de chaque atome.
Trouve le nombre ne d'électrons externes de chaque atome.
Trouve le nombre nl de liaisons covalentes que doit établir l'atome pour acquérir une structure en octet (8 - ne) ou en duet (2 - ne) suivant la règle à laquelle il est soumis
Trouve le nombre nnl de doublets non liants de chaque atome grâce à cette formule c'est + simple:
nnl = (ne-nl)/2
On peut alors dessiner la représentation de Lewis :
Place le(s) doublet(s) liant(s) entre les atomes de la molécule (liaisons covalentes).
Place le(s) doublet(s) non liant(s) autour des atomes qui en possèdent
Vérifie que chacun des atomes de la molécule satisfait à la règle de l'octet en étant entouré de 4 doublets (ou d'un seul doublet pour la règle du duet).
J'espère que ça te servira 
Ah super l'idée
merci beaucoup mjpopo d'avoir pris le temps de me répondre
Il n'y a pas de quoi

Le carbone a 4 électrons sur sa couche externe, et donc pour respecter la règle de l'octet, ce sont 4 doublets non liants.
Je voulais bien sûr écrire "4 doublets liants"
N Z=7 (K)² (L)^5, donc je reprends ce que vous avez dit donc il y aura 3 doublets liants et 3 doublets non liants?
mais normalement c'est 1 doublets non liants
D'après la règle de l'octet, l'atome doit s'entourer de 4 doublets. Sachant qu'un doublet non liant compte pour 2, et un doublet liant compte pour 1, alors pour que les 4 doublets fassent 5, il faut 1 non liant et 3 liant, ce qui fera bien 3+2=5
Sinon, suivons la méthode systématique de shadowmiko
N : (K)²(L)^5
Nombre d'électrons externes : Ne=5
Il y a 3 électrons à acquérir pour acquérir une structure en octet : Nl=3, d'où 3 doublets liants
Il reste 5-2 électrons, que l'on divise par 2, d'où 1 doublet non liant
Conclusion : 1 doublet non liant, 3 doublets liants
Ouf, on trouve la même chose

Si tu te demandes d'où vient cette tendance à parler de structure en octet, c'est qu'en fait l'atome est très stable lorsque ses couches externes sont parfaitement remplies. Ainsi, l'hélium a pour structure (K)^2, et le Néon a une structure : (K)^2(L)^8, ces deux atomes ayant leur dernière couche bien remplie, alors ils sont très stables. Or un atome cherche toujours à se stabiliser, c'est pourquoi les atomes de numéro atomique voisin à celui du Néon vont chercher à avoir 8 électrons sur leur couche externe, d'où la règle de l'octet. Pour les atomes plus proche de l'hélium, ce sera plutôt la règle du duet.
Les atomes d'hélium et de néon étant donc naturellement stables, il est extrêmement rare de les rencontrer dans des réactions chimiques, puisqu'ils sont très bien comme ils sont.
Or un atome cherche toujours à se stabiliser, c'est pourquoi les atomes de numéro atomique voisin à celui du Néon vont chercher à avoir 8 électrons sur leur couche externe, d'où la règle de l'octet. Pour les atomes plus proche de l'hélium, ce sera plutôt la règle du duet.


