Inscription / Connexion Nouveau Sujet
dosage par etalonnage
Bonjour tout le monde, j'ai besoin de votre aide pour un TP de chimie sur le dosage par étalonnage (j'ai déjà fait une grosse partie j'ai simplement besoin que l'on vérifie mes résultats et qu'on m'aide pour les deux dernières questions :/ )
Le permanganate de potassium (KMnO4), ou cristal de condy est un antiseptique utilisé dans des produits pour désinfecter des plaies, les fruits et légumes, traiter les eaux... La teneur en permanganate de potassium de certains sachets du commerce est de 0,25 g par sachet. Elle est vérifiable par analyse chimique.
Préparation des solutions par dilutions:
On dispose d'une solution S de concentration massique 0,20 g/L en permanganate de potassium. Préparer des solutions filles dans les fioles jaugées de 100 mL à partir d'un volume Vs de solution S et compléter avec de l'eau distillée jusqu'au trait de jauge
Réalisation des courbes d'étalonnage : (je vous le met en dessous avec mes valeurs mesurées en classe)
Solution du commerce diluée Sc1 : cette solution a été préparée au préalable en dissolvant un sachet dans 1 L d'eau puis en diluant 10 fois la solution obtenue. La solution du commerce Sc est donc 10 fois plus concentrée. mesurer sa conductivité et son absorbance.
1) Déterminer les concentrations massiques des solutions S1 à S4 (je le mets dans le tableau en dessous)
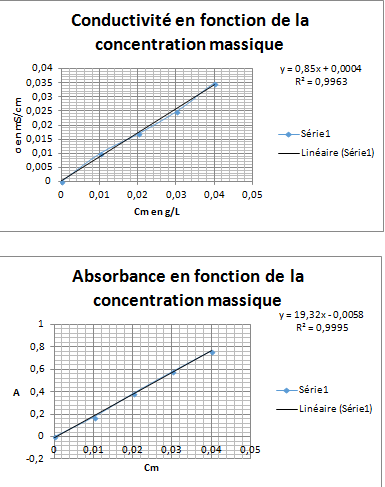
2)a) tracer la courbe de conductivité en fonction de la concentration massique en permanganate de potassium (je vais mettre une photo de ma courbe)
b) tracer la courbe de l'absorbance en fonction de la concentration massique en permanganate de potassium(je vais mettre une photo de ma courbe)
3) modéliser la courbe d'étalonnage sous la forme d'une droite passant par l'origine et noter l'équation sur le graphique
b) cette modélisation est elle pertinente? j'ai mis oui car le coefficient de corrélation est supérieur à 0,99
4) A partir de ces équations calculer la concentration molaire de Sc1
a) par lecture graphique
b) a l'aide de l'équation
Voici ma réponse :
a) Par lecture graphique :
• Spectrophotométrie :
On lit pour A=0,48, Cm(Sc1)=0,025 g/L
Cm=C*M
C= Cm/M
A.N : 0.025/(39.1+54.9+4*16)= 1.6*10-4 mol/L
• Conductimétrie :
On lit pour σ=0,019, Cm(Sc1)=0,023 g/L
Cm=C*M
C= Cm/M
A.N : 0.023/(39.1+54.9+4*16)= 1.5*10-4 mol/L
b) A l'aide de l'équation :
• Spectrophotométrie :
L'équation de la courbe est y= 19.32x-0,0058
D'après les valeurs mesurées, A(SC1)= 0,48
D'où : 0,48=19.32x-0,0058
0,48+0,0058=19,32x
x= (0,48+0.0058)/19.32
Cm(SC1)=0.0251 g/L
Cm=C*M
C= Cm/M
A.N : 0.0251/(39.1+54.9+4*16)= 1.6*10-4 mol/L
• Conductimétrie :
L'équation de la courbe est y=0,85x+0,0004
D'après les valeurs mesurées, σSC1= 0,019
D'où ;
0,019-0,0004=0,85x
x=(0.019-0.004)/0.85
Cm(SC1)=0.0218 g/L
Cm=C*M
C= Cm/M
A.N : 0.0218/(39.1+54.9+4*16)= 1.4*10-4 mol/L
5) en déduire la valeur de la concentration de la solution du commerce Sc avec les deux méthodes
Voici ma réponse :
5) a) Par lecture graphique :
• Spectrophotométrie :
Cm(Sc1)=0,025 g/L donc Cm(Sc)= 0.025*10=0.25 g/L
C(Sc1)=1.6*10-4 mol/L donc C(Sc)=1.6*10-4 *10 = 1.6*10-3 mol/L (car dilué 10 fois)
• Conductimétrie :
Cm(Sc1)=0,023 g/L donc Cm(Sc)=0,023*10=0.23 g/L
C(Sc1)=1.5*10-4 mol/L donc C(Sc)=1.5*10-4 *10=1.5*10-3 mol/L
b) A l'aide de l'équation :
• Spectrophotométrie :
Cm(SC1)=0.0251 g/L donc Cm(SC)=0.0251*10=0.251 g/L
C(SC1)=1.6*10-4 mol/L donc C(SC)=1.6*10-4 *10 =1.6*10-3 mol/L
• Conductimétrie :
Cm(SC1)=0.0218 g/L donc Cm(SC)=0.0218*10=0.218 g/L
CSC1=1.4*10-4 mol/L donc CSC=1.4*10-4 * 10 =1.4*10-3 g/L
6) Déterminer alors la masse de permanganate contenu dans le sachet
7) est elle conforme aux prévisions ?
Je suis bloqué a ces deux dernières questions, enfin si je sais faire la 6 je saurais faire la 7 mais la je suis bloqué :/
Pouvez vous m'aider svp?
Ci dessous: les photos de mes deux courbes de la question 2 et 3
et le tableau avec les valeurs nécessaires.
Solution S0 S1 S2 S3 S4 Sc1
Vs 0 5 10 15 20 ?
σ en mS/cm 0 0,010 0,017 0,025 0,035 0,019
A 0 0,176 0,384 0,578 0,765 0,480
Cm en g/L 0 0,01 0,02 0,03 0,04 ?
bonjour,
avec les valeurs expérimentales fournies,je trouve les mêmes résultats que toi,soit Cm= 0,0251 g/L ou 0,0218g/L
Les C molaires sont correctement calculées.
la solution Sc1 étant obtenue par dilution au 1/10 de la solution Sc,
la concentration de la solution Sc est donc 0,251 g/L ou 0,218 g/L
La valeur indiquée étant 0,25 g/L,est en accord avec la mesure par absorbance mais est en excès par rapport à la valeur obtenue par conductimétrie.
erreur relative (0,25-0,218)/0,25=0,13 soit 13%
Il faudrait confronter ton résultat obtenu par conductimétrie avec d'autres binômes avant de conclure hâtivement que la méthode par spectrophotométrie est meilleure que la méthode par conductimétrie.En effet ,il faudrait que le fabriquant indique l'incertitude absolue sur la valeur indiquée (par exemple +ou- 0,01 g par exemple)