Inscription / Connexion Nouveau Sujet
Dosage par Etalonnage.
Salut,
Mes chères compatriotes...
Voila j'ai un petit problème, et mon petit doigt me dit que vous pourriez y répondre...enfin m'aider du moins.
Ce sont des questions de cour, dans le cadre d'un tépé de spécialité physique-chimie sur le dosage par étalonnage.
Donc voici ces magnifiques questions:
1) Rappeler comment on choisit la longueur d'onde Lamb(a)da de travail afin de vérifier la loi de Bierre-lambert. Quelle courbe doit-on tracer ? quel esr le lien entre lambda et la couleur de la solution ?
2) Resumer les 3 étapes d'un dosage spéctro....
3) L'étiquette de la solution d'acide sulfurique du commerce comporte les info suivantes:
d=1.83
Pourcentage en masse d'acide pur: 98%
M(H2SO4)=98 g.mol -1
A partir de ces données calculer la concentration molaire de la solution commerciale.
Quel protocole proposez vous pour preparé 1.0L de la solution d'acide S... à 2.0mol/L
C'est déja finis ? et ui !! désolé...
Merci de bien vouloir me pretter main forte (de préférence).
Je me tiens disponible pour vous présentez mes réponses.
Bonjour à tous,
Mon cher cousin,
Rappeler comment on choisit la longueur d'onde Lamb(a)da de travail afin de vérifier la loi de Bierre-lambert

Pour ce qui est des questions, voici mes réponses :
1) Je n'arrive pas a trouver la réponse a la 1° partie de cette question... On doit tracer A=f(
 ). La solution absorbe la couleur complmentaire de sa propre couleur : exemple :
). La solution absorbe la couleur complmentaire de sa propre couleur : exemple :
Une solution absorbe le plus dans le violet => la solution est jaune (couleur complémentaire du violet)
2) euh, jvois pas trop...
3) Il me semble avoir trouver quelque chose :
d=\frac{
 acide}{
acide}{ eau} =>
eau} =>  acide = 1,83 kg/L = 1,83*10^3 g/L
acide = 1,83 kg/L = 1,83*10^3 g/L
98% de 1,83*10^3 = 1,79*10^3 g/L ==> C=1,79*10^3 g/L
OUPS trompé... je reprends :
d=\frac{ acide}{
acide}{ eau} => acide = 1,83 kg/L = 1,83*10^3 g/L
eau} => acide = 1,83 kg/L = 1,83*10^3 g/L
98% de 1,83*10^3 = 1,79*10^3 g/L
C= 1,79*10^3 / M(H2SO4) = 1,79*10^3 / 98 = 18,26 mol/L (je sais pas trop combien de chiffres significatifs prendre :s, ça doit etre , ce qui donne juste 18 mol/L, ça me paraît beaucoup, mais bon...)
Le reste viendra 
le reste :
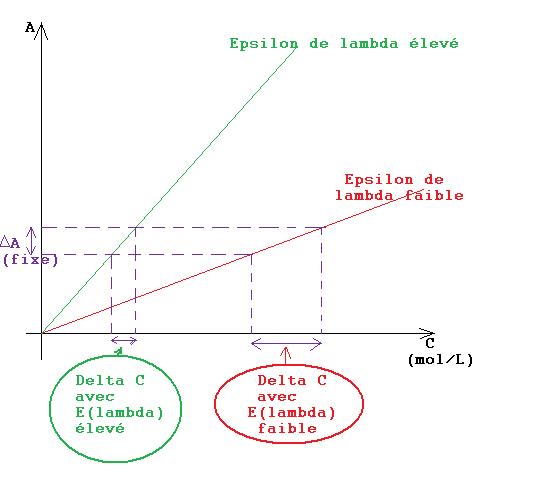
1)Pour la longueur d'onde, il faut la choisir quand l'absorbance est maximal. Ce qui veut dire que le coef. d'extinction molaire  (
( ) est élevé (je crois) Pourquoi cela ? voir le shéma plus bas
) est élevé (je crois) Pourquoi cela ? voir le shéma plus bas  ==> on réduit l'erreur expérimentale sur la concentration
==> on réduit l'erreur expérimentale sur la concentration 
2)Les 3 étapes je dirais :
- Trouver la longueur d'onde pour laquelle l'absorbance est maximale grace a la courbe A=f( ).
).
- Réaliser une echelle de teinte, c'est a dire prendre plusieurs solutions de consentrations connues et de mesurer leur absorbances.Selon la loi de Beer-lambert la consentration est proportionelle a l'absorbance. Ensuite on trace la courbe A=f(c)
- Mesurer l'absorbance de la solution à titrée et grâce à ta courbe A = f(c), tu retrouves la consentration de ta solution.