Inscription / Connexion Nouveau Sujet
Dosage, équivalence
Bonjour
J'aurais besoin d'aide pour cet exercice.
L'énoncé :
On peut lire sur l'étiquette d'une bouteille d'acide chlorhydrique les données suivantes :<< masse volumique : 1190 kg.m-3 ; pourcentage en masse d'acide pur : 37% >>.
1. On extrait de cette bouteille un volume V= 3,23 mL de solution ,qu'on complète à 400 mL avec de l'eau pure . Calculer la concentration de CA de la solution ainsi préparée .
2. Afin de vérifier ce titre ,on dose par cet acide un volume VB = 200 mL d'éthanolate de sodium de concentration CB = 3.10-3 mol/L .Exceptionnellement ,la solution à titrer est placée ici dans la burette .Pour chaque volume d'acide versé ,on relève la valeur du pH et on obtient le tableau suivant :
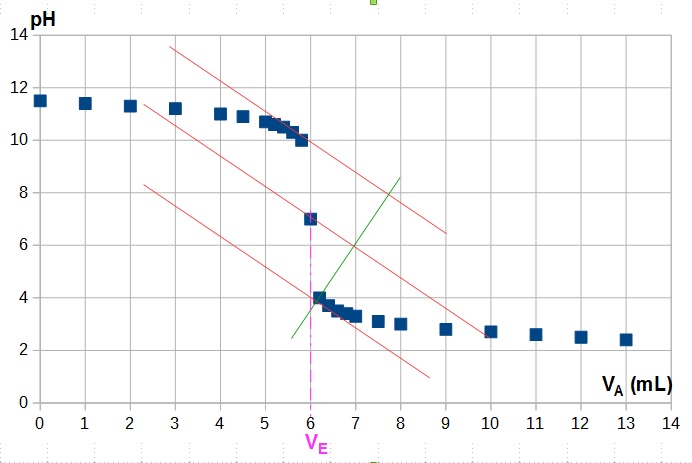
| VA(mL) | 0 | 1 | 2 | 3 | 4 | 4,5 | 5 | 5,2 | 5,4 | 5,6 | 5,8 | 6 |
| pH | 11,5 | 11,4 | 11,3 | 11,2 | 11,0 | 10,9 | 10,7 | 10,6 | 10,5 | 10,3 | 10,0 | 7 |
| VA(mL) | 6,2 | 6,4 | 6,6 | 6,8 | 7 | 7,5 | 8 | 9 | 10 | 11 | 12 | 13 |
| pH | 4,0 | 3,7 | 3,5 | 3,4 | 3,3 | 3,1 | 3,0 | 2,8 | 2,7 | 2,6 | 2,5 | 2,4 |
a) Construire la courbe pH= f(VA)
b) Déterminer le volume d'acide à l'équivalence ainsi que la concentration de la solution d'acide .Conclure.
3. On remplace l'acide chlorhydrique initial par un même volume d'acide nitrique, de même concentration .La courbe précédente est-elle modifiée ? Justifier la réponse .
4. Parmi les trois indicateurs colorés ci-dessous, quels sont ceux qui pourraient servir à un dosage colorimétrique. Comment repérerait-on l'équivalence ?
Helianthine (rouge) 3,1-4,4 (jaune) ,bleu de bromothymol (jaune) 6,0-7,6(bleu), thymolphtaleine (incolore) 9,4-10,6(bleu)
Merci de m'aider à résoudre cet exercice
Re-bonsoir Picard et bonne soirée 
Ici pour la question 1, on peut faire la conservation du nombre de mol d'ion H3O+ ?
Merci 
Si vous croyez que cette question ne doit pas me poser problème, laissez moi y réfléchir un peu .
Merci 
Je n'ai pas encore réussi à faire les relations pour déduire CA
On sait que ms=  *Vs
*Vs
Et la composition centésimale massique= mA/ms non ?
Merci d'avance 
Oui, c'est bien parti.
Juste une précision, l'information...
pourcentage en masse d'acide pur : 37%
Or mA= CA*MA*Vs
CA = (1190*37)/(100
 36.5)= 1,2.103 mol/L
36.5)= 1,2.103 mol/L Tu as oublié le facteur 100....
ETOURDI

Oui et c'est déjà une concentration très élevée.
Cette valeur est celle de la solution d'acide concentré ( la solution de la bouteille) ; il faut maintenant calculer la concentration de la solution diluée.
En route !
Pour les questions suivantes ,on a déjà tracé la courbe.
b) on a ,d'après les 2 tangentes parallèles , Veq= 6,5 mL
Ceq = CBVB/ Veq
Ceq = 9,2 10-2 mol/L
Ensuite on m'a demandé de conclure
C'est bon ?
D'après l'énoncé...
On extrait de cette bouteille un volume V= 3,23 mL de solution ,qu'on complète à 400 mL avec de l'eau pure
Revois ton calcul.
Pour la suite, je dois tracer la courbe avant de te dire ce qu'il en est ; je te répondrai dans la journée.
Quoiqu'il en soit, la méthode est correcte.
Pour conclure, il suffira de comparer les valeurs de la concentration obtenues aux questions 1 et 2.
b) on a ,d'après les 2 tangentes parallèles , Veq= 6,5 mL
Pour la question 3, rien de bien méchant, tu dois t'en sortir seul.
Pour la question 4), le choix d'un indicateur coloré, revois ton cours ; dans l'absolu, l'indicateur doit être tel que pHéquiv
 [zone de virage].
[zone de virage].
Dans le cas d'un dosage acide fort-base forte, comme ici, le saut de pH est si net, que le choix de l'un quelconque des trois indicateurs proposés ne sera pas déterminant...
A toi.
Oui pour la question 1, ce qu'on avait trouvé ce n'etait pas CA demandé...
Donc CA= CV/VA
CA= 0,1 mol/L
Pour conclure :
On a les mêmes concentrations car on est arrivé à l'équivalence
3/
La courbe ne change pas car un acide dosé par une base donne toujours cette allure ?
Merci et bonne nuit
Ceq= 0,1 mol/L ( Q2 ,b )
Pour conclure : On a les mêmes concentrations car on est arrivé à l'équivalence
La valeur trouvée à la question 1, correspond à une oncentration théorique obtenue à partir des données portées sur la bouteille d'acide concentré (masse volumique et % massique d'acide pur).
La valeur obtenue après dosage, correspond à la concentration effective de la solution diluée qui a été préparée.
La concordance des deux valeurs révèle que les indications portées sur la bouteille d'acide concentré étaient exactes.
3/ La courbe ne change pas car un acide dosé par une base donne toujours cette allure ?
A concentrations égales (et même mode opératoire), les courbes de variation du pH en fonction du volume de solution titrante (ou titrée, comme ici) sont les mêmes à condition que l'acide et la base soient tous deux FORTS.
Dans ce cas, la réaction qui se produit est toujours la même : H3O+ + OH-
 2 H2O
2 H2O
Les autres espèces ioniques apportées par l'acide fort et la base forte sont indifférentes.
OK ?
Oui c'est OK je comprends mieux 
Merci beaucoup Picard pour tous ces explications
Ces jours là je suis très fatigué parfois je n'arrive même pas à réfléchir....ou bien, à bien analyser les choses


