Inscription / Connexion Nouveau Sujet
Dosage de l'élément Fer dans un vin blanc
Bonjour à tous, voilà j'ai un TP à rendre, et je bloque pour quelques trucs
1) On doit calculer la masse de sel de Mohr pour 500mL de Solution
Sachant que la formule du sel de Mohr c'est et Je trouve
Et qu'on dispose d'une solution acidifiée de sel de mohr de concentration massique
en ions
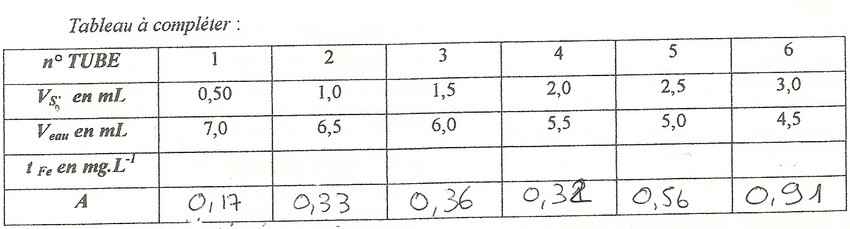
2) On doit remplir un tableau pour ensuite tracer la courbe d'étalonnage. Lors du TP j'ai calculé l'absorbance des 6 tubes.
Pour complèter le tableau je dois calculer en
J'ai dans le tableau
Le Volume de en mL
Le volume d'eau en mL
L'aborbance
Merci de m'aider, bonne journée
dans 500mL de solution il y a 0,25g d'ion Fe2+,puisque la solution est à 0,5g/L
Dans 382 g de sel de Mohr il y a 56 g d'ions Fe2+
la masse de sel de mohr contenant 0,25g d'ions Fe2+ est
m=(392/56)*0,25=1,75g =1,8g
pour la suite ,tu ne donnes pas assez d'indications
Ok merci, je vois.
Et pour ma deuxième question, en fait il s'agit de remplir un tableau pour ensuite tracer la droite Et j'ai les informations suivantes
le volume de S'0 en mL, le volume d'eau et l'aborbance, et il faut que je calcule la concentration de fer grâce à ces données.
Par exemple pour le tube 1 il y a 0.50mL de S'0, 7,0 mL d'eau et l'absorbance est de 0.17 et je dois calculer tFe en mg/L mais je ne sais pas comment faire
quel est le rapport entre S'o et So ?
si on note C'o la concentration de S'o,on opère une dilution en mélangeant 0,5mL de S'o avec 7 mL d'eau Le volume total est 7,5 mL.
La concentration des ions Fe2+ dans le mélange est
C1=C'o*0,5/7,5 =C'o/15
Justement je ne sais pas, il s'agit de tracer ensuite la courbe A=f(tFe) et c'est censé faire une droite passant par l'origine, mais je ne vois vraiment pas comment calculer t(Fe) en mg/L. Je n'ai aps C'0, j'ai juste la concentration massique t'0 et le volume V'0, ensuite de cette solution S'0 on prépare six tubes avec dans chacun 1,5mL de solution d'acide sulfurique à 2mol/L et 1,0mL de solution de thiocyanate de potassium à 2mol/L et après ils disent verser dans cahcun des tubes le volume S'0 et d'eau correspondant dans le tableau.
Donc normalement on est censé trouver t(Fe) sans l'absorbance, comment je peux faire ?
il est difficile de résoudre un pb sans avoir toutes les données.
Dans la question 1 tu parles de 500mL de solution So à 0,5 g/L (c'est sa concentration massique)
dans la seconde partie tu parles d'une solution S'o.
Quel est le lien entre So et S'o?
Je comprends mieux la préparation de la gamme d'étalonnage.
puisqu'on ajoute 1,5mL de H2SO4 et 1mL de thiocyanate on va s'arranger pour que V(S'o)+V(H2SO4)+V(thiocyanate)+V(eau)=10mL
pour le tube 1 on a V(total)=0,5+1,5+1+7=10mL
on aura donc pour chaque tube
t(Fe2+)= to(Fe2+)*v(S'o)/10
to(Fe2+) étant la concentration massique de la solution S'o (que l'on connait ou que l'on peut calculer ?)
ton énoncé étant incomplet,je donne ces réponses avec réserves.
peux tu m'indiquer ,au moins
-le rapport entre S'o et So
-la composition du tube 2 et 6 par exemple
cette fois c'est précis
to=0,5g/L=500mg/L
t'o=50mg/l soit to/10
S'o est donc obtenue en diluant 10fois So.
Puisqu'on veut préparer 100mL de S'o ,on prélève 10mL de So que l'on verse dans une fiole jaugée de 100.O, complète avec le trait de jauge.
pour la concentration de la gamme étalon,c'est ce que je disais.
Le volume total est toujours 10mL
tube 1: t(Fe2+)=t'o*0,5/10=50*0,5/10=2,5mg/L
tube 2 t(Fe2+)=t'o*1/10 =0,5*1/10=5mg/L
etc
D'accord merci mais ya un truc que je comprends pas, pourquoi pour le tube 1 t'0 est remplacé par 50 et dans le tube 2 il vaut 0.5