Inscription / Connexion Nouveau Sujet
Dosage d'un produit ménager
Bonsoir,
je vous mets la partie qui me pose problème:
On trouve dans le commerce des produits liquides servant à déboucher les canalisations obstruées. On peut lire sur l'étiquette « danger, produit corrosif ; contient de l'hydroxyde de sodium (soude caustique) solution à 20 % ». On se propose de vérifier cette teneur en soude par dosage avec une solution connue d'acide chlorhydrique.
Préparation d'une solution diluée
Le produit commercial est trop concentré pour pouvoir être dosé directement. On prépare 500 mL d'une solution diluée 50 fois (solution S).
Dosage pH-métrique
On souhaite doser 20 mL de la solution diluée avec une solution d'acide chlorhydrique de concentration , en utilisant un pH-mètre.
e) Déterminer le volume équivalent en précisant votre méthode.
J'utilise la méthode des tangentes mais j'ai l'impression que lé résultat est faux (voir image)
f) En déduire la concentration de la solution diluée, puis la concentration C de la solution commerciale.
g) Pour réaliser un dosage plus rapide, on aurait pu effectuer un dosage colorimétrique. Préciser le meilleur indicateur coloré à choisir parmi ceux indiqués.
Si j'ai bien utilisé la méthode des tangentes, il faut prendre l'héliantine, la zone de virage se trouvant entre 3,1 et 4,4
h) Déduire du résultat précédent le pourcentage en masse d'hydroxyde de sodium contenu dans le déboucheur.
Masse volumique du liquide déboucheur : 1,208 kg/L.
Masse moléculaire de la soude
masse:
%
i)
Calculer l'écart relatif, en pourcentage, par rapport à la valeur indiquée par le fabricant.
%
Merci de m'aider.
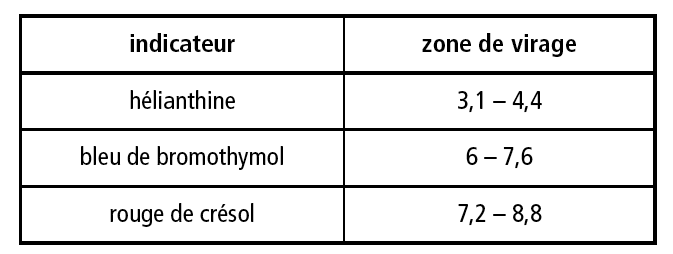
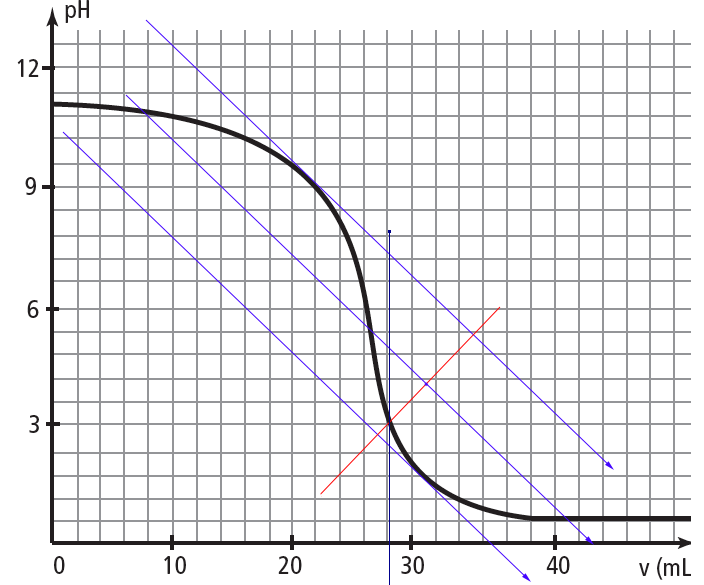
Je pense avoir compris le problème, j'ai mal placé la perpendiculaire rouge, d'ailleurs je ne sais pas pourquoi je l'ai mise là. Donc j'ai refait, par contre ce que je trouve ne rentre dans aucune des zones de virage, j'ai peut-être encore fait une erreur?
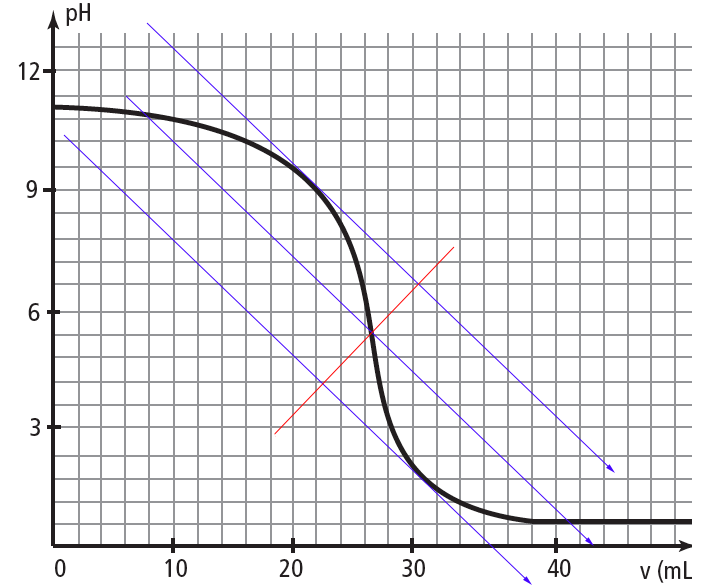
oui,cette fois la méthode est correcte.
On va donc trouver C=0,13 mol/L
La concentration mère est 50 fois plus élevée.
Cmère=50*0,13... =6,6 mol/L
Cmassique=C*M=6,6*40=2,6.102g/L
pour pouvoir comparer avec la concentration annoncée,il faut connaître la densité de la solution commerciale
d'après une table de données une solution à 20% a une densité de 1,22.
1 L de solution à 20% a donc une masse de 1220 g.
La masse d'hydroxyde dans 1L est:
m=1220*0,2O=244g
or tu as trouvé par dosage environ 260g/L.
Ou bien le dosage est mauvais,ou bien le fabriquant minore la concentration réelle
Merci de ta réponse.
Peux-tu me dire comment je fais pour choisir le bon indicateur coloré? Car rien ne passe avec ce que j'ai trouvé.
Ma méthode de pourcentage n'est pas bonne?
Car si C=6,6mol/L alors et
%
Écart relatif: %
Ah non je me rends compte que j'ai confondu la quantité de matière et la concentration molaire. Mais si je calcule la quantité de matière je trouve une masse trop petite:
comme il s'agit dune réaction acide fort base forte ,à l'équivalence,le pH est égal à 7 .l
Il faut choisir un indicateur dont la zone de virage contienne pH=7.Donc BBT
Je ne vois pas l'intérêt de calculer la masse d'hydroxyde de sodium dans 5OOmL.
Écart relatif: 9,5%
je suis d'accord avec ton calcul.
Mais pour trouver 264g j'ai utilisé la formule or moi je me suis trompée je n'ai pas pris "n" mais "C" (6,6mol/L) donc le calcul est faux non?
je ne vois pas ce qui te gène.
ta réponse du 5/04 17h 40 est bonne
il y a 264 g de NaOH dans 1L de solution soit 21,9g dans 100g de solution (pourcentage massique =21,9%)
le calcul de 17h43 ne sert à rien
tu trouves 132g dans 0,5L .C'est évident puisqu'il y a 264g par L
Et bien je ne comprends pas comment ça peut être bon alors que j'ai utilisé la concentration au lieu de la quantité de matière, si la formule est m=nM il faut bien que j'utilise n et non pas C. Même si le résultat est correct je n'ai pas envie de recopier sans comprendre. Merci.
Par contre il faut que je fasse quelques petites corrections.
Donc on se retrouve avec une masse de 260g et avec un pourcentage de 21,5% et un écart de 7,5%
bonjour,
j'avais retenu C=6,6 mol/L car 0,13 mol/L est une valeur arrondie
Il est préférable de faire le calcul de Cmère avec la valeur non arrondie
J'avais choisi Veq=26,3mL dans ce cas
C=0,1*26,3/20=0,1315mol/L arrondi à 0,13 mol/L
Cmère=50*0,1315=6,575 mol/L arrondi à 6,6mol/L
c'est pourquoi j'avais écrit
Cmère=50*0,13..=6,6mol/L Les 2 points indiquent que j'utilise une valeur non arrondie de 0,13
Une autre façon de faire est de réécrire le calcul complet
Cmère=50*(0,1*26,3/20)
Tu peux demander à ton prof la manière de procéder qu'il recommande.
De toutes façons,si dans un problème ,on est amené à utiliser des résultats intermédiaires,il faut utiliser les résultats non arrondis dans les calculs suivants.Les mémoires des calculatrices sont utiles dans ce cas.Sinon il y a un risque d'augmenter l'erreur commise sur le résultat final.


