Inscription / Connexion Nouveau Sujet
dosage conductimétrique
Bonsoir j'ai une petite question à propos d'un exercice, pouvez-vous m'aider svp?
Des consommateurs ont signalé à un fromager que ses fromages étaient trop salés. Il décide de contrôler les ajouts de sels en cours de fabrication ainsi que la teneur en ions chlorure de sa matière première, le lait de vache. Pour cela, il met en œuvre un titrage conductimétrique des ions chlorure. En effet, la saveur salée d'un aliment est liée à la présence de chlorure de potassium et de chlorure de sodium.
La courbe présente 2 domaines d'évoution différents. Interpréter son allure.
Données à 25°C:
 0 Cl-= 76,31.10^-4, NO3-= 71,42.10^-4, Ag+= 61,9.10^-4 m².S/mol.
0 Cl-= 76,31.10^-4, NO3-= 71,42.10^-4, Ag+= 61,9.10^-4 m².S/mol.
Equation de la réaction support de ce dosage: Ag+ + Cl- -> AgCl
Merci.
Bonsoir
Et si tu commençais par proposer des réponses et dire ce que tu n'as pas compris ? Il sera plus facile de t'aider de façon efficace ensuite.
Je n'ai pas compris comment on interprète l'allure de cette courbe, à part dire qu'elle est décroissante puis croissante et que le point ou les deux droites se croisent correspond au volume équivalent.
Pose toi la question suivante:
quand on introduit en solution un ion argent et un ion nitrate, quels sont les ions qui restent en solution et ceux qui disparaissent? Quelle conséquence sur la conductivité cela a-t-Il? Tu devras distinguer 2 cas : avant et après l'équivalence.
Tu devrais ainsi montrer que la conductivité diminue faiblement en fonction de la quantité de nitrate d'argent ajoutée avant l'équivalence puis augmente rapidement après.
Ce sont les ions nitrate qui disparaissent et les ions argents qui restent en solution.
Les ions nitrate ont une conductivité plus élevée que les ions argent donc la conductivité diminue.
Ensuite, à partir du volume équivalent, on a des ions chlorure et des ions argent donc la conductivité ne peut que augmenter?
Et j'ai une dernière question svp: je dois faire un schéma du dispositif de titrage donc ca, c'est fait mais on me demande de justifier la nécessité d'ajouter une grande quantité d'eau distillée dans le bécher.
J'ai répondu pour homogénéiser la solution mais je ne sais pas si c'est ça..
Bonsoir
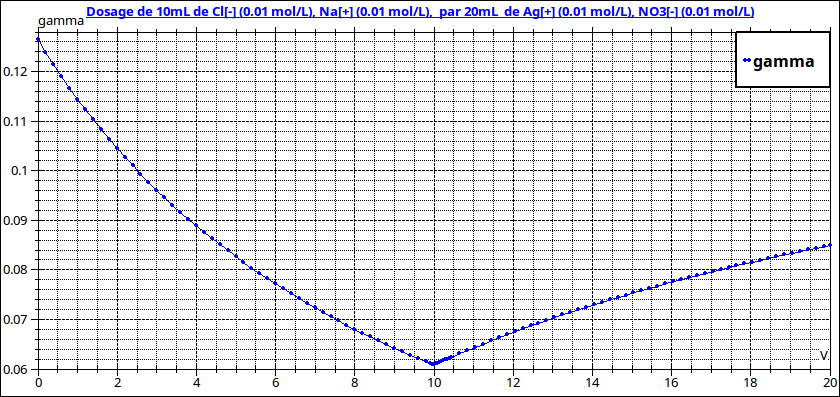
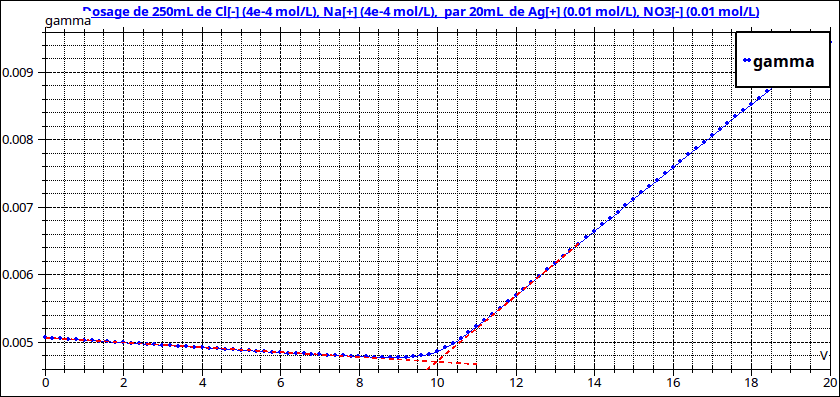
Tu poses une excellente question, un peu difficile en terminale mais tu te débrouilles très bien ! La raison principale est la suivante : si le volume ajouté de solution titrante (ici nitrate d'argent) n'est pas négligeable devant le volume initial de la solution à doser (ici chlorure de sodium) les deux « branches » de la courbe sont des branches d'hyperbole et non des segments de droite comme tu peux le constater ci-dessous. Dans le premier cas, les concentrations en NaCl de la solution à doser et en AgNO3 de la solution titrante sont égales.Dans le second cas, la quantité de NaCl est la même (même volume équivalent donc) mais la solution de NaCl a été diluée 25 fois. L'équivalence est toujours obtenue au minimum de conductivité. Dans le premier cas, ce minimum apparaît clairement car mon ordinateur a calculé un très grand nombres de valeurs mais en TP, tu n'as qu'une vingtaine de points expérimentaux. Si les branches ne sont pas assimilables à des segments de droites, il n'est pas possible d'utiliser la méthode graphique permettant de déterminer l'équivalence.
Je te fais la démonstration uniquement pour V>Ve en notant Co la concentration en NaCl et Vo le volume de cette solution avant ajout de la solution de AgNO3 de concentration C. Tu peux faire seul la démonstration pour V<Ve...
La quantité de Na+ est la quantité initiale car ces ions ne réagissent pas :
Après l'équivalence, tous les ions chlorure ont disparu. Les ions argent sont ceux introduits après l'équivalence, ceux introduits avant ont disparu par précipitation avec les ions chlorure :
Les ions nitrate ne réagissent pas :
D'où l'expression de la conductivité au cours du dosage après l'équivalence :
Il s'agit de l'équation d'une branche d'hyperbole. En revanche, suppose : V<<Vo , l'équation précédente se simplifie :
Il s'agit de l'équation d'une droite affine !
Remarque, suivant les auteurs, la conductivité est notée sigma ou gamma, mon logiciel utilise gamma...