Inscription / Connexion Nouveau Sujet
Accueil l'île de la physique - chimie Forum de physique - chimieListe de tous les forums de physique - chimie LycéeOn parle exclusivement de physique/chimie, niveau lycée. TerminaleForum de terminale ChimieTopics traitant de Chimie [tout]Lister tous les topics de physique - chimie
Niveau terminale
DM de Chimie
Posté par lemarchand
Bonjour,
J'ai un DM à faire pour vendredi prochain et j'ai quelques difficultés dans cette matières, c'est pour cela que je me tourne vers vous pour corrigé mes erreurs. Le DM est composé de différente parties, je commencerais donc par la première, si j'ai un problème les autres partie posterais un nouveau message.
Citation :
Objectif : Montrer qu'un système évolue spontanément vers un état d'équilibre.
On étudie la réaction chimique d'équation :
}) +
+ }) =
= }) +
+ 
de constante d'acidité .
.
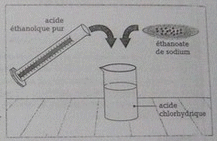
- Réaliser les deux mélanges 1. et 2. selon les indications données dans les documents 1 et 2 (Voir image jointe)
- Mesurer le pH des deux mélanges réalisés précédemment :
}) (mélange 1) = 3.4 ;
(mélange 1) = 3.4 ; }) (mélange 2) = 4
(mélange 2) = 4
Objectif : Montrer qu'un système évolue spontanément vers un état d'équilibre.
On étudie la réaction chimique d'équation :
de constante d'acidité
- Réaliser les deux mélanges 1. et 2. selon les indications données dans les documents 1 et 2 (Voir image jointe)
- Mesurer le pH des deux mélanges réalisés précédemment :
Voici les question accompagné de mes réponses :
1°) Préciser les espèces chimiques présentes à l'état initial :
Mélange 1 :
Mélange 2 :
2°) En considérant que l'acide éthanoïque pur n'est pas dissocié et que l'éthanoate de sodium est totalement dissocié dans l'eau, calculer les concentration initiales des espèces chimiques figurant dans l'équation de la réaction :
Mélange 1 : [
[
[H_3O^+] = 0 mol/L
Mélange 2 : [
[
[H_3O^+] = 0 mol/L
3°) Quel serait le pH de la solution si le système n'évoluait pas ?
Pour le Mélange 1 et le Mélange 2, je dirais que le pH serait le même à l'état initial qu'a l'étal final de la réaction.
4°) A partie de la mesure du pH de la solution, peut-on affirmer que le système a évolue spontanément ?
5°) A l'aide du document 3, calculer le quotient de réaction associé a l'équation de la réaction initial.
6°) La valeur du quotient de la réaction dans l'état initial est-elle égale à la constante d'équilibre K ? Conclure.
Pour ces trois question je reste coincé, car pour la question 5°), il n'y a aucun document 3°)
Merci de votre aide, et sil vous plaît pas de réponse toutes, faite seulement me dire ou j'ai faux en me laissant un petit indice de réflexion ^^, merci !
Voici une photo du devoir en question :

Edit Coll : image et tableaux laissés ; énoncé effacé (il est recopié ci-dessus)


