Inscription / Connexion Nouveau Sujet
devoir chimie PH
bonjour j'ai besoin d'aide pour un devoir en chimie : je suis en terminal S
voici le sujet
Nous allons nous intéresser dans ce DM au phénomènes des pluies acides qui peuvent entraîner des déséquilibres dans certains milieux, qui doivent être solutionnés.
Documents
Doc. 1: Acidité naturelle de l'eau de pluie
Le dioxyde de carbone atmosphérique réagit avec l?eau des nuages pour former l?acide carbonique H2CO3(aq) .
Il s'agit d'un diacide dont les couples acide/base sont H2CO3(aq)/HCO- 3(aq) pKa1 = 6.4 et HCO- 3(aq)/CO2- 3(aq) pKa2 = 10.4.
Ce diacide réagit à son tour avec l'eau, ce qui entraîne un pH voisin de 5.6 pour une eau de pluie normale, c?est-à-dire non polluée.
Doc. 2 : Pluies acides
Des polluants libérés dans l'atmosphère sont susceptibles de faire baisser le pH de l'eau de pluie.
Pour des pH inférieurs à 5.6 on parle de pluies acides.
Il n?est pas rare de mesurer des pH de pluies à 4 ou 3.
Le record absolu mesuré date de 1979 aux Etats-Unis, à 1.5.
Doc. 3 : Pollution et acidification des eaux de pluies
Les polluants responsables de l'acidification des précipitations sont principalement le dioxyde de soufre SO2(g) et le dioxyde d?azote NO2(g) qui se dissolvent dans l?eau en formant de l'acide sulfurique H2SO4(aq) et de l?acide nitrique HNO3(aq) , lesquels retombent ensuite au sol sous forme de pluies, neiges, dépôts secs et dépôts gazeux, et ce, après avoir parcouru des milliers de kilomètres.
Doc. 4 : Chaulage d'étangs
Les étangs sont des milieux très favorables au développement de formes de vies très diverses.
Si l?eau est trop acide, certains organismes ne peuvent pas développer et cela a un impact fort sur la biodiversité et sur la chaîne alimentaire de la zone.
Prenons l'exemple d'une étang qu'on modélise par un cylindre de rayon 300m et de profondeur 1.50m.
Le pH mesuré est à 4.2 et il faudrait le remonter au moins à 5.0.
Pour cela on peut utiliser la technique du chaulage qui consiste à rajouter du carbonate de calcium CaCO3(s) de masse molaire 100g/mol et sous forme de poudre, dont le coût n'est pas trop élevé (60e la tonne).
Doc. 5 : Analyse des causes de l?acidité de certains étangs
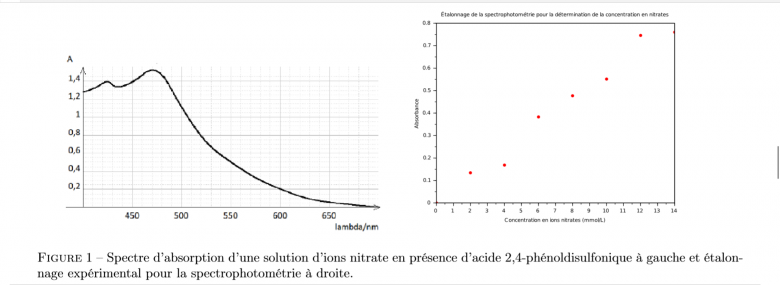
A?n de savoir si la trop grande acidité d?un étang est due aux pluies acides, on peut doser la quantité d'ions NO- 3(aq) ou SO2- 4(aq). Par exemple, pour doser les ions nitrates, on peut utiliser la spectrophotométrie.
En effet, en présence d'acide 2,4phénoldisulfonique, les ions nitrates réagissent totalement et rapidement avec apparition d'une coloration jaune.
Le spectre de la solution obtenue est donné ci-dessous.
Après choix d'une longueur d'onde, on réalise un certains nombre de solutions étalons dont la concentration en nitrates est connue et on mesure l?absorbance.
Le graphe est également donné ci-dessous (1).
Doc. 6 : rappels de géométrie
Un disque de rayon R a une surface qui s'exprime par PiR².
Un cylindre est un volume dont la base est un disque et de hauteur notée h.
L?expression de son volume est alors la surface du disque multipliée par sa hauteur.
Questions 1. Dans de l'eau de pluie non polluée, sous quelle forme est majoritairement l?acide carbonique? Vous pourrez justifier à l'aide d'un diagramme de prédominance.
2. L'acide nitrique est un acide fort, l?acide sulfurique est un diacide fort.
(a) Rappelez ce qu'est un acide fort.
(b) Écrire les équations des réactions de chacun de ces acides avec l'eau.
3. On considère l'étang d'un des documents.
(a) Quelle est la concentration d'ions oxonium de l'étang trop acide
(b) Quelle devrait être la concentration en ions oxonium pour le pH ciblé?
(c) En déduire la quantité de matière d?ions oxonium qu'il y a en trop dans le lac 4. On réalise une opération de chaulage pour améliorer le pH. On suppose que l'ion carbonate CO2- 3(aq) se comporte ici comme une dibase forte, qu'on peut noter B2-.
(a) Écrire la réaction de la dibase B2- avec les ions oxonium.
(b) Faire un tableau d'avancement avec la dibase comme réactif limitant.
(c) Quelle est la relation entre la quantité de dibase apportée dans l?étang et la quantité d'ions oxonium neutralisés?
5. Combien coûtera l'opération de chaulage pour atteindre le bon pH de l'étang?
6. Que fait la température de l'étang avec le chaulage?
On s'intéresse maintenant aux ions nitrates pour savoir si l'acidité trop élevée de l?étang provient de fumées toxiques contenant du dioxyde d'azote.
7. Expliquez et donnez la longueur d'onde utilisée pour la spectrophotométrie.
8. (a) Montrez que l'étalonnage expérimental correspond à la loi de Beer-Lambert.
(b) Déterminez approximativement l'équation de la courbe de régression
9. Pour l'échantillon du lac, on mesure une absorbance de 0.71. Déterminez la concentration en ions nitrates dans l'étang.
10. Étant donné que l'acide nitrique est un acide fort, quel devrait être le pH de l'étang si tous les ions nitrates provenait d?acide nitrique de pluies acides. Conclure.
***Présentation sujet reprise***
Bonjour,
Ce n'est pas la première fois que tu postes ici, tu connais donc les règles du forum :
Tout comme lors de ton premier sujet posté, on ne te répondra pas si tu n'es pas pro-actif dans la résolution de ce dernier : qu'as-tu fait ? Où en es-tu ?
D'autre part, tu as des fiche de cours sur notre site si jamais tu ressens le besoin de réviser le chapitre avant de nous proposer tes pistes.
alors j'ai fait les 2 premiere questions ;
1) jai trouvé H2Co3 qui predomine 2) acide fort ( acide qui réagit totaolement avec l'eau )
Pour les autre questions jai besoin de PISTES car je ny arrive pas
j'ai bien lu le réglement du forum donc oui je je cherche bien les exercices avant de les poster
quelqu1 peut me dire si c 2 questions sont au moins correcte ?
3) SO2(g)+ NO2(g) ? SO2(g)+H20 pour lacide sulfurique ?
SO2(g)+ NO2(g) ? N02-(g)+H20 pour lacide nitrique ?
Pour la 3)a) j'utilise le doc 5
et j'ai la relation c=n/v mais comment continuer ??
Pour la 3)b) je peux utiliser le doc 4 qui dit :Le pH mesuré (donc ciblé ) est à 4.2 et il faudrait le remonter au moins à 5.0. Pour cela on peut utiliser la technique du chaulage qui consiste à rajouter du carbonate de calcium CaCO3(s) de masse molaire 100g/mol et sous forme de poudre,
je ne sais pas si ce que je fais est juste ; jai besoin de pistes je suis trop bloqué
aidez moi pleease
***Pistes rassemblées dans un message => le flood n'est pas autorisé***
je propose ma reflexion ; j'ai besoin de savoir si ma reflexion est bonne pour ce genre de devoir qui est presque de niveau bac +1 vu que notre prof est un prof de prépa integré .. je connais le chapitre , j'ai juste besoin de quelques pistes pour me débloquer car ce devoir n'est pas facile ; a tout les autre devoir j'y arrive sauf a celui la qui me pose des difficulté
sil vous plait
Bonjour,
Si tu ne reçois d'aide sur le forum, c'est que quelque chose cloche : je t'ai mis en rouge les choses de l'énoncé correspondantes : il est incomplet ...
Ce qui m'ennuie ensuite c'est que les premières questions sont des applications directes du cours et tu ne les proposes pas.
Voici ce que je propose :
1) Complète ton énoncé en insérant les choses manquantes ;
2) Va potasser cette fiche de cours et reviens avec des pistes de réflexion : ![]()
-------------------------------------------
Si quelqu'un veut prendre ma suite sur le sujet je passe la main volontiers.
j'ai répondu aux 2 premières questions et mes pistes de réflexion sont dans la réponse plus haut ... je le redis je connais le cours et je vous ai mis les reponses aux 2 premieres questions vous les avez vu ? les autres questions sont plus difficiles et j'ai besoin de pistes
..... besoin de pistes meme minim ..
Bonsoir,
Comme indiqué par gbm je pense que l'absence de réponses est du à un énoncé incomplet (spectre de l'absorption et absorption en fonction de la concentration).
alors j'ai fait les 2 premiere questions ;
1) jai trouvé H2Co3 qui predomine
Ceci est une affirmation non justifiée : Aucun intérêt !
Remarque : H2Co3 n'existe pas (Co est le symbole du cobalt), tu as probablement voulu dire H2CO3
2) acide fort ( acide qui réagit totaolement avec l'eau )
Oui
3) 2b) SO2(g)+ NO2(g) ? SO2(g)+H20 pour lacide sulfurique ?
SO2(g)+ NO2(g) ? N02-(g)+H20 pour lacide nitrique ?
Tes réponses sont fausses.
Pour répondre correctement il faut connaître les formules de ces deux acides et savoir écrire l'équation bilan d'un acide sur l'eau.
Bref, il faut connaître le cours !


 moteur de recherche
moteur de recherche page de choix du forum
page de choix du forum fiches du site
fiches du site