Inscription / Connexion Nouveau Sujet
Demi pile résolution de problème
Bonjour j'ai une résolution de problème à faire mais je suis bloqué dans mon raisonnement j'ai déjà une petite idée de comment faire voilà l'énoncé :
Il est possible d'alimenter un écran à cristaux liquides avec des piles « citron ». Pour chaque pile, une pièce de monnaie en cuivre Cu(s) et un trombone recouvert de zinc Zn(s), sont piqués dans un citron dont le jus acide contient des ions hydrogène H+(aq). Chaque trombone est déplié et seule une longueur L = 2 cm est plantée dans le citron.
• La masse de zinc déposée sur chaque trombone permet-elle à la pile d'alimenter l'écran pendant une durée ∆t =5 min si l'intensité I du courant est égale à 10 mA ?
Données :
- Le trombone peut être assimilé à un cylindre de rayon R = 0,50 mm, l'épaisseur de la couche de zinc est e = 100 µm.
- Surface de la couche de zinc en contact avec le citron : S = 2 × π × R × L + π × R2.
-M(Zn) = 65,4 g·mol-1 ; ρ(Zn) = 7,14 g·cm-3.
- Relation entre l'intensité I (en A), la quantité d'électricité débitée Q (en C) et la durée de fonctionnement ∆t (en s) : Q = I × ∆t.
- NA= 6,02 × 1023 mol-1 et e = 1,6 × 10-19 C.
- Zn2+(aq) / Zn(s) ; H+(aq) / H2(g).
Alors voilà mon raisonnement :
1) Calculer le volume de la couche de zinc V
2) En déduire la masse de cette couche m
3) Déterminer la quantité de matière n(Zn) de zinc grâce à la masse volumique
4) Calculer la quantité de matière ne des électrons
5) Calculer la capacité de la pile Q
6) En déduire la durée de fonctionnement de la pile t
7)Conclure
Résolution:
1) V=S*e=0.13 cm^3
2) ρ(Zn)=m/V donc m=ρ(Zn)*V=0.93 g
3) n(Zn) = m/M(Zn) = 1.4*10^-2 mol
4) Là je bloque je ne vois pas comment justifier que Zn est le réactif limitant et en déduire ne. Je n'ai aucune indication sur le branchement de la borne COM ou A et en plus je n'ai pas les couples du cuivre dans les données mais seulement de H+ et je ne vois pas en quoi H+ peut m'aider... Si quelqu'un pouvait m'aider s'il vous plait et me dire si mon raisonnement est juste.
Merci d'avance 
Voici quelques éléments susceptibles de t'aider :
Quand la pile fonctionne il se produit deux transformations chimiques :
a) A l'électrode en cuivre une réduction : 2H+(aq) + 2e- --> H2(g)
Les ions H+ sont amenés par le jus acide du citron ( acide citrique )
b) A l'électrode en zinc une oxydation : Zn(s) --> Zn2+(aq) + 2e-
Le métal cuivre ne participe pas au processus chimique.
La 1/2 équation d'oxydation montre que pour chaque mole de Zn consommé il circule 2 moles d'électrons.
Chaque mole d'électrons qui circule porte une charge q= NA * e = 6,02.1023 * 1.6.10-19 = 96320C
La charge totale Q qui circule pendant la durée ∆t est Q = I * ∆t.
A partir de q et Q on obtient la quantité (en mol) d'électrons ayant circulé et on en déduit la quantité (toujours en mol ) de Zinc consommé.
Et maintenant je te laisse réfléchir ....
Ah mais comment pouvais-je savoir que l'hydrogène réagissait avec le cuivre ? En tout cas là j'y vois un peu plus clair mais je ne peux toujours pas justifier que le zinc est le réactif limitant.
Si c'est le réactif limitant je sais que Q=ne*Na*e et ne/2 (car il y a deux électrons) = n(Zn) donc ne = 2*n(Zn) e là je trouve 2,8*10^-2 mol
Je peux calculer Q qui est donc égale à 2,7*10^3 C (2696)
Et là je sais que Q est aussi égale à I*t et je connais I = 10mA et t=5min=8,3*10^-2 h et je trouve Q= 0,83 mAh
Sauf que là niveau unité je suis perdu
En gros je sais que je dois comparer les deux capacité et voir si celle que le zinc permet est plus grande ou égale à celle nécessaire pour une durée de 5min à cette intensité pour conclure. Vous pourriez m'éclairer sur le réactif limitant, les unités et mon raisonnement s'il vous plait ?
Ah mais comment pouvais-je savoir que l'hydrogène réagissait avec le cuivre ?
Relis mon post du 01-02-21 à 23:56 : Je précise bien que le cuivre ne participe pas au fonctionnement de la pile.
L'énoncé donne les couples Zn2+(aq) / Zn(s) et H+(aq) / H2(g) cela aurait pu te guider pour trouver la réaction qui a lieu dans la pile.
Zn(s) + 2H+(aq) --> Zn2+(aq) + H2(g)
En première approximation la pile fonctionne jusqu'à épuisement du Zinc. Les ions H+ fournis par le citron sont en large excès : C'est bien le zinc qui est le réactif limitant.
Comme déjà indiqué dans mon précédent post la charge totale Q qui circule pendant la durée ∆t
est Q = I * ∆t. (Relation 1)
Cette même charge Q peut se calculer à partir du nombre "n" de moles d'électrons ayant circulé
Chaque mole d'électrons porte la charge q = NA * e
NA est la constante d'Avogadro et "e" est la charge élémentaire portée par un électron : Ce sont deux constantes dont les valeurs sont données dans l'énoncé.
Donc Q = n * q = n*NA * e (Relation 2)
Je te laisse faire exprimer à partir des relations 1 et 2 le nombre n de moles d'électrons ayant circulé pendant le fonctionnement de la pile en fonction de I, ∆t, NA et e
Enfin en te servant de la 1/2 réaction d'oxydation tu exprimeras n(Zn) la quantité de matière de Zinc consommée toujours en fonction de I, ∆t, NA et e
Remarque : Il est inutile et même nuisible de se précipiter pour l'instant sur les valeurs numériques et sur les problèmes de conversion. Cela viendra plus tard.
D'accord alors on a donc ne = (I*t)/(Na*e) et comme il y a deux électrons échangés lors de l'oxydation du zinc : n(Zn)=ne/2=(I*t)/(2*Na*e).
Sauf que là je ne vois pas du tout en quoi ça m'aide je ne sais même plus quoi faire...
OK,
Tu as donc obtenu la quantité n(Zn) = I *  t / (2 * NA * e ) nécessaire pour le fonctionnement de la pile dans les conditions décrites par l'énoncé.
t / (2 * NA * e ) nécessaire pour le fonctionnement de la pile dans les conditions décrites par l'énoncé.
Tu vas maintenant rechercher la quantité n'(Zn) disponible sur la partie de trombone en contact avec le citron
Si n'(Zn) 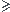 n(Zn) alors la pile permettra d'alimenter l'écran.
n(Zn) alors la pile permettra d'alimenter l'écran.
Pour obtenir n'(Zn) :
Aire S de la zone de contact entre le trombone et le citron : S =  R² + 2
R² + 2 RL =
RL =  R (R + 2L)
R (R + 2L)
Volume de cette zone : V = S * h ( Je note "h" l''épaisseur de la couche de Zinc à la place de "e" fixé par l'énoncé pour éviter la confusion avec la charge élémentaire)
Masse "m" du zinc en contact avec le citron : m =  (Zn) * V
(Zn) * V
Quantité de matière disponible de Zinc : n'(Zn) = m / M(Zn)
A toi d'exprimer n'(Zn) en fonction de R, h,  (Zn), L, M(Zn)
(Zn), L, M(Zn)
Ici aussi : Pas de valeur numérique pour l'instant !
Ah mais oui mais j'ai compris!! Oui du coup la quantité de zinc que j'avais calculé au tout début est celle disponible et c'était 1,4*0^-2 mol pour la trouver il faut donc faire n'(Zn)=(ρ(Zn)*S*h)/M(Zn)= (ρ(Zn)* (2 * π *R * L + π * R^2)*h)/M(Zn).
Mais maintenant pour conclure j'ai besoin des unités pour les calculs pour n'(Zn) il n'y a pas de soucis avec les unités mais pour n(Zn) je ne vois pas trop comment on peux arriver à des mols
Si j'utilise les unités du système international j'ai donc des A.s sur des mol^-1.C cela me fait des moles ??
I est en A,  t en secondes, NA en mol-1 (Relire l'énoncé si nécessaire) et e en Coulomb
t en secondes, NA en mol-1 (Relire l'énoncé si nécessaire) et e en Coulomb
Tu sais probablement que 1A * 1s = 1C
Donc
A * s /( mol-1 * C) = mol
Au final on obtient bien des moles
Ah ouii non je ne me rappelais plus de cela on a donc bien des moles effectivement merci beaucoup de votre aide grâce à vous j'ai pu finir mon exercice 
Bonne journée 
OK
Je te signale que je n'ai pas trouvé le même résultat que toi pour n'(Zn)
Comme tu n'exposes pas le détail de ton calcul qui aboutit à n'(Zn) = 1,4.10-2 mol je ne peux pas vérifier lequel des deux ( ou bien tous les deux !) a fait une erreur de calcul.
Je te conseille tout de même de revérifier.
Si j'utilise les unités du système international j'ai donc des A.s sur des mol^-1.C cela me fait des moles ??
Salut Tania je voulais savoir si on pourrait parler en privé concernant la physique chimie par e-mail. Promis rien de bizarre ou quoi mais j'aurais une ou deux question à te poser concernant ton année passée. Mon e-mail est le suivant : ***adresse mail supprimée*** Merci d'avance


 profil
profil à côté de votre pseudo). De plus, l'affichage de cet email est même géré de façon à gêner sa récupération par d'éventuels robots spammeurs, sans pour autant gêner l'affichage pour les membres réels du site.
à côté de votre pseudo). De plus, l'affichage de cet email est même géré de façon à gêner sa récupération par d'éventuels robots spammeurs, sans pour autant gêner l'affichage pour les membres réels du site.

