Inscription / Connexion Nouveau Sujet
Courbe et réaction
Bonjour
Je dois faire un exercice mais je n'ai pas compris (j'ai passé trop de temps dans le cours, et je n'ai pas du tout compris)
Voici:
Pour vérifier la concentration d'une solution commerciale, on procède à un titrage pH-métrique des ions lactate contenus dans cette solution.
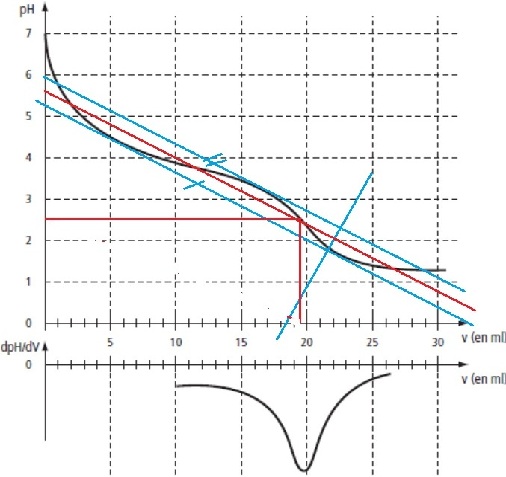
On prélève un volume V1 = 20,0 mL de solution S de lactate de sodium et l'on y verse une solution d'acide chlorhydrique H3O+(aq) + Cl-(aq) de concentration molaire en soluté apporté C2 = 1,00mol.L^(-1). On mesure le pH au fur et à mesure de l'addition d'acide. On obtient la courbe (image).
1. Écrire l'équation de la réaction du titrage, la transformation associée étant considérée comme totale.
Bon je ne suis pas sûre mais j'ai quant même essayé:
Cl- + H3O+  HCl- + H20
HCl- + H20
2. Déterminer graphiquement le volume d'acide versé à l'équivalence V2E , en indiquant la méthode choisie.
J'ai choisi la méthode des tangentes (image) et le point équivalent est : V2(e) =19mL
3. En déduire la concentration molaire en soluté apporté C1 de la solution de lactate de sodium. On pourra s'aider d'un tableau d'avancement.
Là je ne sais pas comment faire de tableau d'avancement. Pourriez vous m'aider ?
4. Pour vérifier que la réaction support du dosage est bien totale, on se place dans un cas particulier avant l'équivalence lorsque l'on a versé 9,0 mL d'acide.
a. Calculer la quantité d'ions oxonium HO3+ introduite dans ces conditions.
Là je n'arrive pas à faire le lien avec les ions oxonium et la quantité versée (9,0mL d'acide)
b. Le pH de la solution est alors égal à 4,0. Calculer la quantité d'ions oxonium HO3+ alors présente dans la solution.
c. En déduire que la transformation pouvait être considérée comme totale.
Il faudrait que je comprends le début de l'exercice pour pouvoir faire la fin.
Est-ce que vous pouvais m'aider, s'il vous plait?
bonjour,
Une solution de HCl ne contient que des ions H3O+ et Cl- (HCl est un acide fort)
l'ion Cl- est indifférent .
H3O+ réagit avec l'ion lactate CH3CHOHCOO- que je désigne A- pour simplifier.
l'équation de réaction est A- + H3O+ = AH +H2O
A l'équivalence la qté de matière de H3O+ introduite est égale à la qté de matière d'ions lactates.
[H3O+]*V(H3O+]eq=[A-]*V(A-)


