Inscription / Connexion Nouveau Sujet
Corrosion galvanique d'un métal, en contact avec un autre métal
Bonjour à tous,
je cite Wikipédia dans son article sur la corrosion galvanique (pile électrochimique) :
"Pour avoir une corrosion galvanique, trois conditions sont nécessaires :
1) Des métaux de nature différente : C'est la différence de potentiel de dissolution entre les deux métaux qui provoque le phénomène. L'expérience montre qu'il faut une différence de potentiel de 100 mV pour voir apparaître la corrosion. "
N'est-ce pas incomplet ?
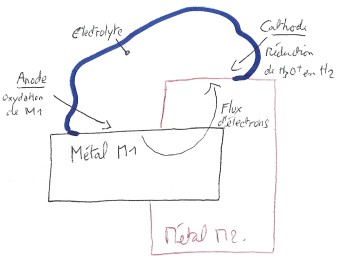
Ne faudrait-il pas ajouter qu'il est également nécessaire que le potentiel du métal M1 soit inférieur ou potentiel de la réduction H30+/H2 et que le potentiel du métal M2 soit supérieur au potentiel de la réduction H30+/H2 ? A ce moment-là, ce deuxième métal sera la cathode. (cf. croquis ci-joint)
Car si l'on se contente de dire qu'il suffit, entre autres choses, que la différence de potentiel entre les 2 métaux soit supérieure à 100mV pour obtenir une pile(cf. Wikipédia), alors on peut avoir oxydation de M1 et de M2 en même temps, dans le cas où les potentiels de M1 et M2 sont tous les deux inférieurs au potentiel de la réduction H30+/H2 (E=0V). Et donc on n'aura pas à proprement parler une pile (pas de flux d'électrons bien net dans un sens)
Ce n'est que mon avis / ma compréhension, j'aurais besoin d'une confirmation ou d'une rectification svp.
Merci