Inscription / Connexion Nouveau Sujet
Constitution d'un atome.
Bonjour !
J'ai un problème. j'ai un dm a faire sur la constitution d'un atome et j'ai répondu a la premier question où je ne suis pas sur mais je dois ensuite complété un tableau mais j'y comprend rien voici:
1° Un atome isolé est électriquement neutre. Quelle relation y a-t-il entre le nombre de protons et le nombre d'électron ? (avec cette question il y a une phrase disant: la particule de proton a une charge(C) de 1,602*10puissance-19 et une masse (Kg) de 1,6726*10puissance-27. La particule de neutron a une charge (C) de 0 et une masse (Kg) de 1,6749*10puissance-27. Et la particule d'électron a une charge de de -1,602*10puissance-19 et une masse (Kg) de 9,1093*10puissance-31)
réponse: La relation qu'il y a entre la particule de proton et la particule d'électron est qu'elle sont opposé. (je ne suis pas sur de ma réponse)
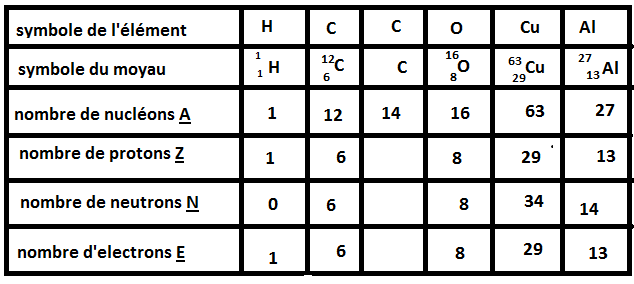
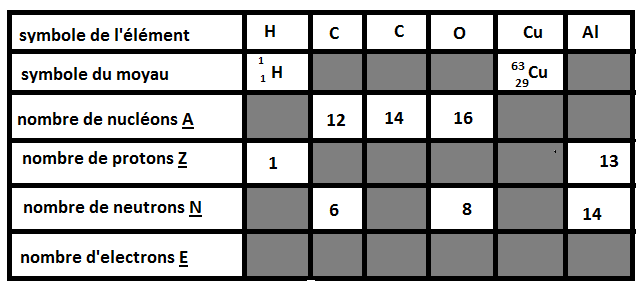
2° il faut complété le tableau au dessous (la j'y arrive pas,je le comprend pas). quelqu'un peu m'aidais a comprendre ce tableau pour remplir les cases grise svp
merci pour votre aide 
Bonjour,
Le proton :
masse:1,673×10-27 kg
charge:+e
éléctron:
masse:9,109 382 6(16)×10-31 kg
charge:-e
c'est pour la question 1 donc la réponse est : La relation qu'il y a entre la particule de proton et la particule d'électron est que leur charge sont opposée.
c'est juste ?
Bonjour,
Un atome est composé d'un noyau et d'un nuage électronique.
Le noyau est composé de protons (particule chargée positivement +e) et de neutrons (particule de charge électrique nulle). Ces deux particules sont regroupées dans une catégorie qu'on appelle nucléons. Donc: nucléons = protons + neutrons. Ces deux particules ont quasiment la même masse et c'est ce que l'on suppose dans certains exercices.
Le nuage électronique est composé d'électrons (particule chargée négativement -e). La masse d'un électron est très faible et est donc négligeable devant la masse du noyau ==> On dit que la masse de l'atome est concentrée dans le noyau.
Si maintenant on s'interesse à la classification périodique des éléments, on a:
Cet élément est l'élément X (qui n'existe pas mais c'est juste le cas général), il est composé de A nucléons et de Z protons.
Comme c'est un atome, il est électriquement neutre donc il y a autant de protons que d'électrons ==> protons=Z et électrons=Z
Si on veut connaitre la composition du noyau, il faut savoir combien de neutrons composent le noyau, il suffit d'utiliser la formule: nucléons=protons+neutrons <=> A=Z+N
Donc si on récapitule: on a un élément X qui possède Z protons et Z électrons et A-Z neutrons.
Dernière remarque: Un élément est déterminé par son nombre de protons! Par exemple si on prend le carbone 12 et le carbone 14, ces deux atomes possèdent 6 protons, 6 électrons mais un nombre de neutrons différents que l'on calcule en faisant 12-6=6 neutrons et 14-6=8 neutrons.
Voilà je pense que ce récapitulatif peut t'aider à remplir ton tableau.
Si on prend l'atome d'oxygène O, on te donne le nombre de nucléons A=16 et le nombre de neutrons N=8
Connaissant A et N, on peut facilement trouver Z: A=Z+N <=> Z=A-N=16-8=8 protons
Le noyau est composé donc de 16 nucléons : 8 protons et 8 neutrons.
Maintenant pour le nombre d'électrons, on sait qu'un atome est électriquement neutre donc E=Z=8 électrons
Merci j'ai tout compris juste pour le deuxième c du tableau on nous donne que le nucléon 14 comment on peu avoir les autres nombre ?
Et pour la question 1 c'est juste?
Oui pour la question 1 c'est juste.
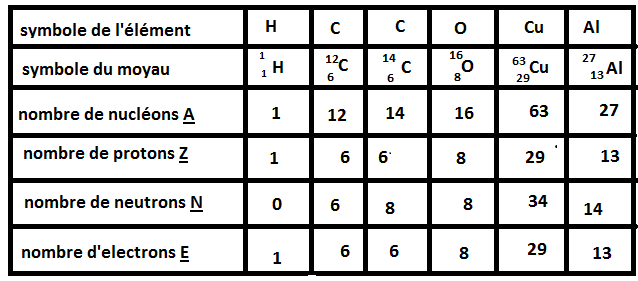
Pour la question du deuxième C, le carbone 14, je t'ai dit tout à l'heure qu'un atome est déterminé par son nombre de protons. Un atome qui aura 8 protons sera forcément un atome d'oxygène mais il pourra avoir un nombre de neutrons différents c'est ce qu'on appelle des isotopes.
Donc si on te donne une fois dans l'énoncé le nombre de protons de l'atome de Carbone, tu sais que ce nombre ne changera pas que ça soit du carbone 14 ou du carbone 12.
Le symbole du noyau c'est ce que je t'ai mis tout à l'heure, tu prend le symbole de l'élément par exemple O et tu places en haut à gauche le nombre de nucléons et en bas à gauche le nombre de protons:
Je vais te prendre l'exemple de l'hydrogène. L'hydrogène est composé de 1 proton, de 1-1=0 neutron et de 1 électron.
Le deutérium, qui est un isotope de l'hydrogène, noté a forcément le même nombre de protons (et donc d'électrons) que l'hydrogène mais un nombre de neutron différent: 1 proton, 1 électron et 2-1=1 neutron.
Le tritium, un autre isotope de l'hydrogène, noté a forcément le même nombre de protons que l'hydrogène: 1 proton, 1 électron et 3-1=2 neutrons.
Seul le nombre de protons nous indique de quel élément il s'agit, il faut ensuite trouver le nombre de neutrons pour savoir quel isotope c'est.
Le carbone 12 possède 6 protons, 6 électrons et 12-6=6 neutrons.
Le carbone 14 possède donc 6 protons, 6 électrons et 14-6=8 neutrons. Si tu n'avais pas la colonne du carbone 12 avant tu ne peux pas, juste avec les données de l'énoncé, connaitre la composition de l'atome de carbone 14 car il te manquerait le nombre de protons du carbone.
d'accord merci j'ai compris et en même temps j'ai compris ce qu'été un isotope merci donc le tableau finale fait sa ?
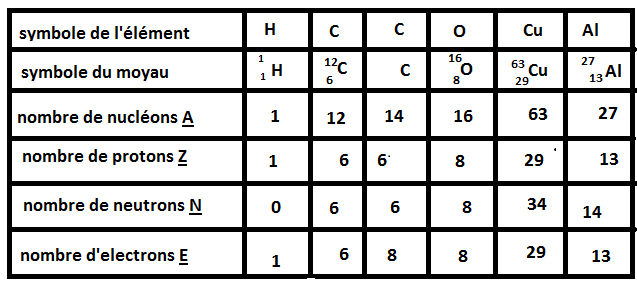
Non, soit c'est une erreur d'inattention soit tu n'as pas réellement compris. Tu as mis que l'atome de carbone 14 possède 6 protons et 8 électrons. Ceci n'est plus un atome mais un ion car un atome est électriquement neutre, il y a autant de protons que d'électrons. Mais si c'est simplement parce que tu as inversé les deux lignes neutrons-électrons c'est bon car le carbone 14 possède 8 neutrons et non 6.
Pour le symbole du noyau ça donne quoi alors ?
J'ai une autre question si sa ne te dérange pas pour la question suivante on nous demande de calculer la masse du noyau de l'atome de fer symbolisé par 56 (comme nucléons) et 26 (comme proton) Fe?
Avec comme référence proton = 1,673.10-27 Kg. Puis neutrons = 1,675.10-27 Kg. Et électrons = 9,109.10-31 Kg
Comment on fait pour calculer ?
d'accord merci 
Il demande de calculer la masse du noyau de l'atome de fer symbolisé par 56 (comme nucléons) et 26 (comme proton) Fe?
Avec comme référence proton = 1,673.10-27 Kg. Puis neutrons = 1,675.10-27 Kg. Et électrons = 9,109.10-31 Kg
Comment on fait pour calculer ?
La masse d'un atome est égale à la somme des masses des particules le composant. C'est comme si tu calculais la masse de ta voiture, c'est la masse du chassis + la masse des sièges + la masse du volant ....
Pour les atomes c'est pareil: la masse de l'atome est égale à aux nombre de protons multiplié par la masse d'un proton + le nombre d'électrons multiplié masse d'un électron + le nombre de neutron multiplié par la masse d'un neutron.
Ca c'est pour la masse d'un ATOME, on te demande la masse du NOYAU c'est donc la même formule sans les électrons car ils ne font pas parti du noyau mais du nuage électronique.
Ah non tu ne peux pas prendre les infos du tableaux vu que le Fer n'est pas dedans mais tu fais exactement la même démarche. Tu détermines le nombre de protons et de neutrons et tu utilises les données des masses.
OK merci donc j'ai fait le calcule:
la masse du noyau = (26*1,673.10-27)+(56*1,675.10-27)= 1,37298.10-25
la masse de l'atome = 1,37298.10-25 + (26*9,109.10-31) = 1,37321683.10-25
c'est juste ?
J'ai continué le dm est je bloque encore il me demande :
Comparons le rayon d'un noyau avec celui de l'atome. Pour mieux visualiser, supposons que le noyau soit une tête dépingle (de rayon 1mm)? Quel serait le rayon de l'atome ?
Bonjours jumujum,
je pense que tu devrais essayer le produit en croix. Pour cela il faudrait que tu connaissent le rayon exacte de l'atome et du noyau.
on nous donne comme information les ordre de grandeur du noyau de l'atome qui est 10-15 et et celle de l'atome qui est de 10-10 je fait le produit en crois avec sa ?
euh.. ben si tu n'as que ces infos là, le produit en croix sera pas possible.
Tu me pose une colle ! je vais réfléchir à la question sérieusement.. je suis désolé de n'avoir pas répondu à ta question..
Je vais y réfléchir !!
Pardon petite erreur, je recommence:
atome: 10-10 m ---> x mm
noyau: 10-15 m ---> 1 mm
Voilà c'est mieux. Bien sûr x est le rayon de l'atome si le rayon de l'atome était de 1 mm
Donc si on met ça en m: x=102 m
Cela veut dire que si le noyau avait un rayon de 1 mm, les électrons qui gravitent autour du noyau (en supposant qu'ils tournent suivant une trajectoire circulaire) seraient à 100m du noyau.
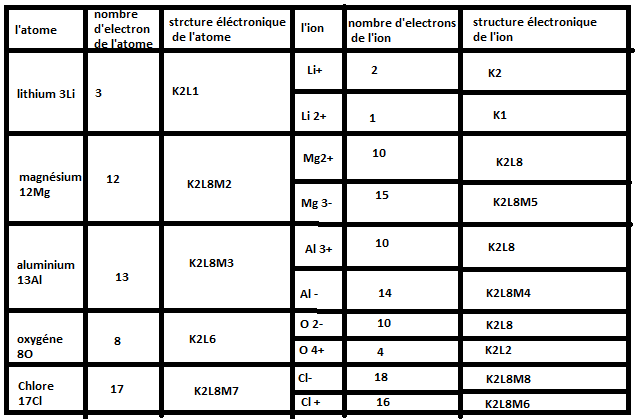
désoler j'ai encore avancé sur mon dm est l'avant derniere question c'est encore un tableau que la aussi je ne comprend pas :
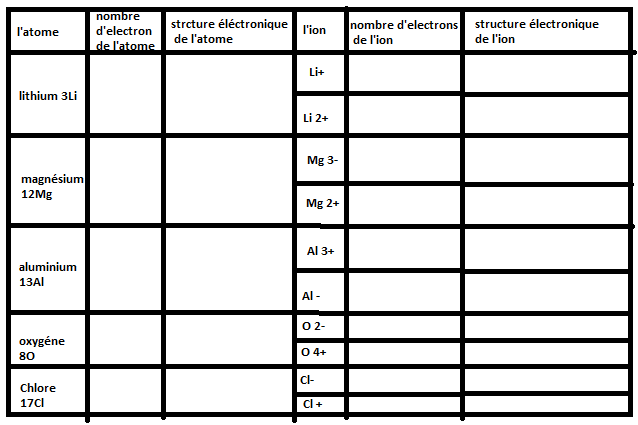
Bon la première colonne à remplir, tu dois savoir le faire si tu as compris la deuxième question de ton exercice.
Pour la deuxième colonne à remplir, je pense que tu as du voir en cours la structure électronique d'un atome sous la forme de plusieurs couches K, L, M, ... Cherches voir combien d'électrons tu peux placer au maximum par couche et essaies de remplir cette colonne tout seul. (Une fois qu'une couche électronique est remplie entièrement, on remplie la couche suivante jusqu'à avoir "rangé" tous les électrons)
Contentes toi déjà de remplir ces deux colonnes et on verra la suite.
pour la première collone c'est fait sa donne dans l'ordre 3, 12, 13, 8 et 17 mais pour la deuxieme collone je l'ai pas vu en court
Ok pour les deux colonnes sauf l'avant dernier pour l'oxygène, c'est: (K)2(L)6 ce qui fait bien 8 électrons et non 6 comme tu as mis.
Bon si tu as compris ça je pense que le reste ne sera pas compliqué.
La notation veut dire que l'ion est un cation, c'est un ion positif ce qui veut dire qu'il a PERDU un ou plusieurs électrons (un électron est négatif donc si tu perds un électron, tu perds une charge négative donc ta charge totale n'est plus nulle mais positive).
La même chose avec , c'est ce qu'on appelle un anion, un ion négatif qui a GAGNE un ou plusieurs électrons.
Le nombre que tu vois devant le + ou le - t'indiques le nombre d'électrons gagnés ou perdus. Si tu as +, c'est que l'atome a perdu 1 électron. Si tu as 3+, c'est que l'atome a perdu 3 électrons. Si tu as 2-, c'est que l'atome a perdu 2 électrons.
Bon maintenant pour revenir plus clairement sur ton exercice: tu connais le nombre d'électrons de chacun de ces atomes et tu connais maintenant le nombre d'électrons gagnés ou perdus, tu peux donc remplir la 3ème colonne.
Je te fais le 1er si tu veux: Li+ est un cation, un ion positif qui a perdu un électron. Sachant que l'atome Li possède 3 électrons alors l'ion Li+ possède 3-1=2 électrons. Sa structure électronique est par conséquent (K)2.
Oui voilà. Par contre je suppose qu'il te reste une question après qui te demande de préciser quels sont les ions qui existent réellement, non ?
Pas tout ta fait il me reste bien une question qui me demande:
Pour Li+, Mg2+, Al3+, O2- et Cl-. Que remarque t-on pour leur structure electronique ?
Oui c'est vrai mais on te demande de trouver un point commun par rapport à ce que tu as fait juste avant. Regardes la structure électronique de chacun des ions cités, qu'ont-ils de différents des autres?
Si Cl- a des électrons sur la 3ème couche. Est ce que tu connais la règle de l'octet et la règle du duet?