Inscription / Connexion Nouveau Sujet
Concentration
Bonjour a tous j'ai une question concernant cette exercice pourriez-vous m'aider s'il vous plaît?
Un chimiste dissout 123 mg de nitrite de calcium dans de l'eau distillée jusqu'à atteindre un volume de 0,250 L (solution A), Il prélève 10.0 mL de cette solution qu'il place dans un ballon jaugé de 50.0 mL. Il porte au trait de jauge avec de l'eau distille et obtient une solution finale B. Quelle est la concentration de la solution finale (B)?
Je sais qu'il faut utiliser cette formule
C2=c1×v1 /v2
Mais il trop de volume
Je comprends pas il faut soustraire
0.250 l- 10 ml parcque on prélève 10 ml et puis les ajouter dans 50 ml
Je comprends pas trop quelqu'un peut m'aider ?
Bonjour,
Pourrais-tu expliquer et justifier ce que tu fais ?
Tu as une fiche de cours pour réviser si besoin : ![]() [lien]
[lien]
Il faut poser le problème tout comme proposé par celle-ci :
Etape 1 : détermination de la concentration en quantité de matière de la solution A
Etape 2 : détermination de la concentration en quantité de matière de la solution B :
Solution mère (une partie de la solution A prélevée) :
Ca = ...
Va = ...
Solution fille B :
Cb = ?
Vb = ...
L'ajoute d'eau ....

Ca
J'ai fait n=m/Masse molaire
0,133/132.089=9,3×10^-4
Ca=n/v
9,3×10^-4 /0,250 =3,72×10^-3
Mais je sais pas le si a 0,250L je dois tirer les 10ml
Et pour le c2 quelle volume prendre
50 ml +10 ml?
Des résultats sans unité n'ont aucun sens physique ou chimique.
Ensuite je ne comprends pas ta phrase "Mais je sais pas le si a 0,250L je dois tirer les 10ml "
Et "c2" ne fait pas partie des notations que j'ai définies Je te conseille de reprendre ça sur la base de la trame proposée.

Parce que il prélève 10ml de cette solution qu'il place dans un ballon de 50ml
Je sais pas sis il faut soustraire 10ml de 250ml? Car il prélève
Encore une fois rédige tel que proposé :
Etape 1 : détermination de la concentration en quantité de matière de la solution A
(détailler son raisonnement + unités aux résultats finaux)
Etape 2 : détermination de la concentration en quantité de matière de la solution B :
Solution mère (une partie de la solution A prélevée) :
Ca = ...
Va = volume prélevé = ...
Solution fille B :
Cb = ?
Vb = ...
L'ajoute d'eau ....
Donc on peut écrire ...

Etape 1
n= 0,123/132,089 = 9,3×10^-4 mol
Etape 2
CA = 9,3×10^-4 M
VA =0,250 L
C= 9,3×10^-4/ 0,250 = 3,7×10^-3 M
CB = je sais pas
VB =50+10=60 ml
Il faut sérieusement que tu améliores ta rédaction car ça va te porter préjudice lors d'un examen.
Etape 1 : détermination de la concentration en quantité de matière de la solution A
La concentration molaire de la solution A vaut par définition Ca = n/V
avec n quantité de matière en nitrite de calcium introduit et V = 250 mL le volume de la solution préparée.
Or par définition de la quantité de matière : n = m/M
m étant la masse de nitrite de calcium introduit et M sa masse molaire
donc finalement Ca = m/[M*V]
Application numérique :
m = 123 mg = ... g
M = M(Ca(NO2)2) = M(Ca) + 2M(N) + 6M(O) = ... g/mol
V = 250 mL = 0,250 L
donc Ca = ... mol/L (M est une unité complètement désuète)
Etape 2 : détermination de la concentration en quantité de matière de la solution B :
Solution mère (une partie de la solution A prélevée) :
Ca = valeur calculée à l'étape 1 = ... mol/L
Va = volume prélevé = 10,0 mL
Solution fille B :
Cb = ? = c'est ce qu'on cherche justement
Vb = 50,0 mL
L'ajoute d'eau ne modifie pas la quantité de matière en nitrite de calcium introduit donc on peut écrire
Ca x Va = Cb x Vb <=> Cb = ?
Application numérique :
...
Etape 1 : détermination de la concentration en quantité de matière de la solution A
La concentration molaire de la solution A vaut par définition Ca = n/V
avec n quantité de matière en nitrite de calcium introduit et V = 250 mL le volume de la solution préparée.
Or par définition de la quantité de matière : n = m/M
m étant la masse de nitrite de calcium introduit et M sa masse molaire
donc finalement Ca = m/[M*V]
Application numérique :
m = 123 mg = ... g
M = M(Ca(NO2)2) = M(Ca) + 2M(N) + 6M(O) = 132,08 g/mol
V = 250 mL = 0,250 L
donc Ca = 0,093 mol/L (M est une unité complètement désuète)
Etape 2 : détermination de la concentration en quantité de matière de la solution B :
Solution mère (une partie de la solution A prélevée) :
Ca = valeur calculée à l'étape 1 = 0,093 mol/L
Va = volume prélevé = 10,0 mL
Solution fille B :
Cb = ? = c'est ce qu'on cherche justement
Vb = 50,0 mL
Cb×vB=Ca×vA
Cb×0,05=0,093×0,250
cb=0,465 mol/l je n'obtient pas la réponse du correctif
Cb= 7,45×10^-4
Je ne trouve pas du coup la même valeur pour la concentration molaire de la solution A :
Ca = 3,72.10-3 mol/L
La suite est donc à reprendre ...
Cb×vB=Ca×vA
Cb×0,05=0,093×0,250
Complètement faux, tu n'as même pas lu ce que j'ai écrit (extrait du message du 17-11-20 à 12:32) :
Solution mère (une partie de la solution A prélevée) :
Ca = valeur calculée à l'étape 1 = ... mol/L
Va = volume prélevé = 10,0 mL
Solution fille B :
Cb = ? = c'est ce qu'on cherche justement
Vb = 50,0 mL
Ouf ! Gagné  !
!
Garde cette fiche sous le coude, ça peut te resservir : ![]() [lien]
[lien]
Je t'en prie, à une prochaine fois !
Bonjour,
Je conseille, pour l'avenir, à Kouchi de " traduire " l'énoncé par un schéma comme, par exemple, celui représenté ici.
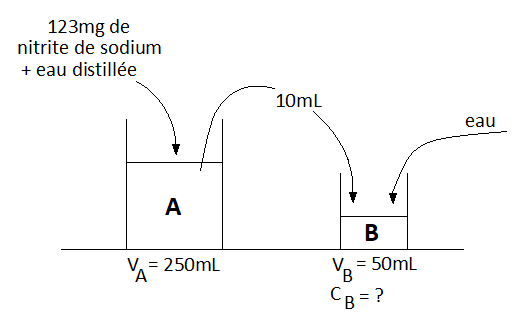
Salut odbugt1,
Oui, ces bons vieux schémas  !
!
Il fut un temps, où je prenais le temps de les faire systématiquement en chimie, de manière à montrer qu'on peut résumer l'essentiel d'un énoncé par ce biais (et donc éviter les erreurs par la suite).
Le temps désormais me manque, merci de le combler.
Bon après-midi !


