Inscription / Connexion Nouveau Sujet
Coloration d'une solution en fin de réaction
Bonsoir,
J'ai besoin d'aide pour un exercice.
Voici le sujet :
On considère deux systèmes réqctionnels, sièges de la même ré&action d'équation : 2 S2O32-(aq)+I2 (aq)  S4O62- (aq) + 2 I- (aq).
S4O62- (aq) + 2 I- (aq).
La seule espèce colorée est le diiode I2, de couleur brune.
1. Comment évolue la coloration de chaque système au cours de la transformation ? Justifier.
2. Les quantités de matière initiales des réactifs sont :
Système 1 : ni(I2) = 6,0 x 10-4 mol et ni(S2O32-) = 7,0 x 10-4 mol.
Système 2 : ni(I2) = 5,0 x 10-4 mol et ni(S2O32-) = 7,0 x 10-4 mol.
Lequel des deux sys-mes aura la coloration la plus intense en fin de réaction ? Justifier.
Ce que je pense :
1. Au cours de la transformation la coloration de chaque système devient brune, puis vire au brun foncé. car l'intensité augmente.
2. Le système 1 aura la coloration la plus intense en fin de réaction car sa quantité de matière initiale est plus grande.
Mais je crois que c'est faux...
Merci
au cours de la réaction ,I2 disparait progressivement ,donc l'intensité de la coloration diminue.
fais un tableau d'avancement et calcule la qté de matière de réactifs restant
bonsoir,
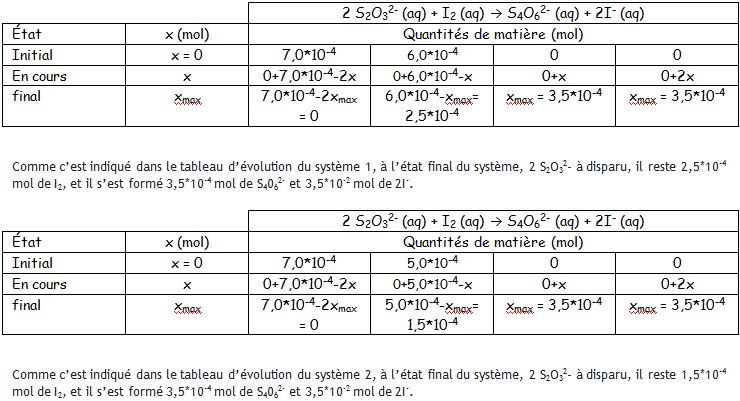
voici en attachement les deux tableaux d'avancements du système 1 et 2.
Donc je pense que c'est le système 1 qui aura la coloration la plus intense en fin de réaction car le système 1 la quantité de matière de I2 est plus grande au système 1 qu'au système 2.
et pour la 1 c'est ça alors ? :
1. Au cours de la transformation, I2 disparaît progressivement, donc l'intensité de la coloration diminue.
pour la 2 ,je suis d'accord,mais ta réponse 1 est fausse puisque la coloration diminue progressivement .I2 est un réactif.Sa concentration diminue au cours de la réaction.
c'est ce que j'avais déjà écrit
au cours de la réaction ,I2 disparait progressivement ,donc l'intensité de la coloration diminue.



