Inscription / Connexion Nouveau Sujet
Cinétique chimique
Bonjour, je suis en difficulté face à une question d'un exercice.
L'eau oxygénée commerciale est une solution aqueuse de peroxyde d'hydrogène utilisée comme désinfectant pour des plaies, pour l'entretien des lentilles de contact ou comme agent de blanchiment. . Le peroxyde d'hydrogène (H2O2) intervient dans deux couples oxydant-réducteur : H2O2 (aq) / H2O(l) et O2 (g) / H2O2 (aq).
Le peroxyde d'hydrogène est capable dans certaines conditions de réagir sur lui-même c'est à dire de se dismuter selon l'équation de réaction suivante :
2H2O2 (aq) =2H2O(l) +O2(g)
Cette réaction est lente à température ordinaire mais sa vitesse peut être augmentée en présence d'un catalyseur. Données :
Volume molaire des gaz dans les conditions de l'expérience : V = 25 L×mol-1.
1.1°) Écrire les deux demi-équations d'oxydoréduction des deux couples auxquels le peroxyde d'hydrogène appartient.
H2O2 + 2H+ + 2e-= 2H2O
O2 + 2H+ + 2e-
1.2°) Compléter le tableau d'évolution du système en annexe à remettre avec la copie.
désolé, j'ai cliqué publier au lieu de visualiser. Je reprends donc à la question 1.2.
pour la q2, voir la photo.
La dismutation du peroxyde d'hydrogène est une réaction lente mais qui peut être accélérée en utilisant par exemple des ions
fer III (Fe 3+ (aq)) présents dans une solution de chlorure de fer III, un fil de platine ou de la catalase, enzyme se trouvant dans le
sang. L'équation de la réaction associée à cette transformation est donnée dans l'introduction (réaction 1).
2.1°) Donner la définition d'un catalyseur.
Un catalyseur est une espèce chimique capable de diminuer la durée d'une transformation, mais qui n'est ni produit ni consommé par la réaction
2.2°) À quel type de catalyse correspond la catalyse réalisée par un fil de platine ? (justifier)
Il s'agit d'un catalyseur hétérogène car il n'est pas dans la même phase que les réactifs.
La transformation étudiée est catalysée par les ions fer III. On mélange 10,0 mL de la solution commerciale d'eau oxygénée avec 85 mL d'eau. À l'instant t = 0 s, on introduit dans le système 5,0 mL d'une solution de chlorure de fer III.
Au bout d'un temps déterminé, on prélève 10,0 mL du mélange réactionnel que l'on verse dans un bécher d'eau glacée. On titre alors le contenu du bécher par une solution de permanganate de potassium afin de déterminer la concentration en peroxyde d'hydrogène se trouvant dans le milieu réactionnel.
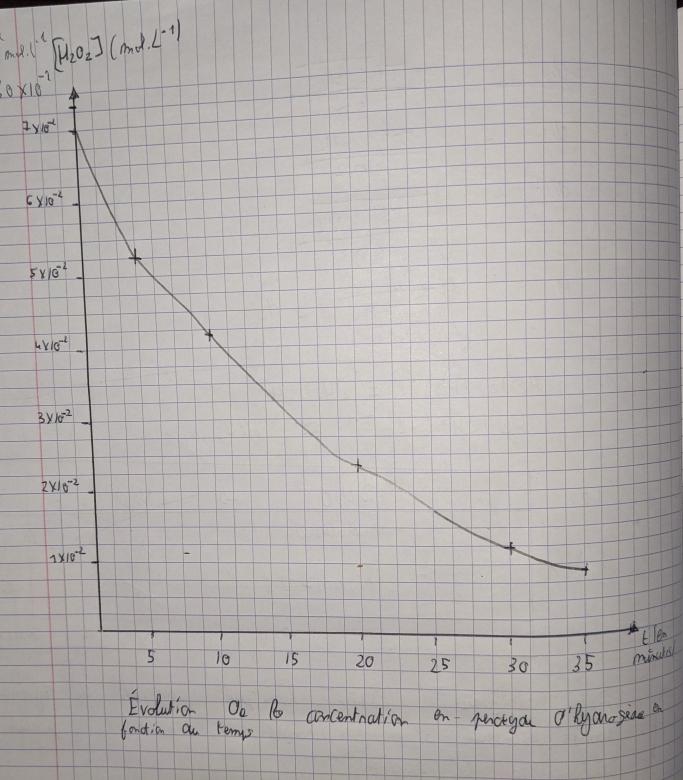
On obtient les résultats suivants :
| t(min) | 0 | 5 | 10 | 20 | 30 | 35 |
| [H O ] mol.L-1 | 7,30×10-2 | 5,25×10-2 | 4,20×10-2 | 2,35×10-2 | 1,21×10-2 | 0,90×10-2 |
2.3°) Tracer sur la feuille de papier millimétré à remettre avec la copie l'évolution de la concentration en peroxyde d'hydrogène en fonction du temps.
Échelles : en abscisses 2 cm pour 5 min
en ordonnées 2 cm pour 1 × 10-2 mol.L-1
voir l'image
2.4°) En utilisant le tableau d'évolution du système proposé en annexe, exprimer l'avancement de la transformation x(t) en fonction de nt(H2O2) quantité de peroxyde d'hydrogène présent à l'instant t et de n0(H2O2) quantité initiale de peroxyde d'hydrogène.
n0 (H202) - 2x = nt (H2O2)
x(t) = (n0 (H202) - nt (H2O2) ) /2
2.5°) La vitesse volumique v de la transformation chimique est définie comme étant le rapport de la dérivée de l'avancement
1 dx(t) x(t) en fonction du temps par le volume V du système : v =
En utilisant la relation obtenue à la question 2.4, démontrer que cette vitesse v peut être exprimée par la
d [H O ] relation suivante :v=
Alors c'est là que ça se corse :
v =
Après je ne sais plus quoi faire
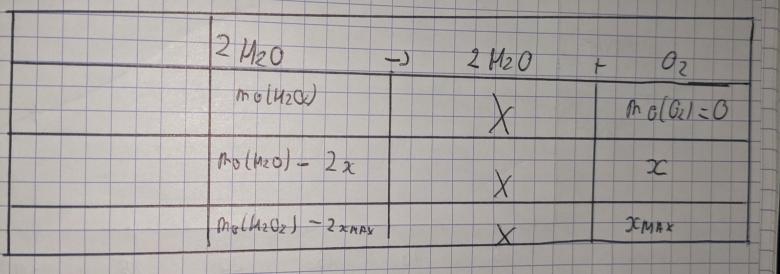
malou edit >** j'ai tourné les images**rafraîchir la page pour en profiter**
Bonjour,
Question 1.1
Ta demi-réaction H2O2 + 2H+ + 2e-= 2H2O est exacte l'autre est fausse.
Question 2.1 :
Concernant le catalyseur il vaut mieux dire : qu'il participe aux différentes étapes de la réaction mais il est restitué à la fin du processus
Impossible !
Tu aurais alors deux demi-réactions de réduction.
La solution :
H2O2 + 2H+ + 2e- = 2H2O (Réduction)
H2O2 = O2 + 2H+ + 2e- (Oxydation)
--------------------------------------------------------------------------------
2 H2O2 = 2H2O + O2
Non.
Ce que tu avais écrit (02-12-21 à 18:26) puis répété (02-12-21 à 20:01) est faux car écrit à l'envers.
La bonne demi équation est une oxydation :
H2O2 = O2 + 2H+ + 2e-
alors que tu proposais une réduction :
O2 + 2H+ + 2e- = H2O2
Je ne sais plus comment te convaincre :
Tu avais écrit correctement ta première 1/2 réaction qui était une réduction.
La deuxième 1/2 réaction est nécessairement une oxydation.
Ce que tu as écrit est une autre réduction.
Une réaction d'oxydo-réduction est une superposition d'une oxydation et d'une réduction.
Ce n'est pas la superposition de deux réductions
Si tu essaies " d'additionner " tes deux réductions tu n'obtiendras pas le bilan global correct.
En particulier la conservation des charges électriques ne sera pas respectée.
ok je comprends mieux le problème de rigueur de mon écriture.
Merci de me l'avoir particulièrement bien expliquée.
Oublie la dernière ligne de mon explication :
"En particulier la conservation des charges électriques ne sera pas respectée."
Question 2.5 :
Par définition :
v = (1/V) * dx(t)/dt
On a montré que :
x (t) = (1/2) [ n0 (H2O2) - nt (H2O2) ]
Je dérive x(t) par rapport à t :
dx/dt = - (1/2) d [nt (H2O2) ] / dt
Je reporte dans la définition de v :
v = (- 1/(2V)) * d[nt (H2O2) ] / dt
Enfin je réécris l'expression de v :
v = - (1/2) d [nt (H2O2)/V ] / dt
v = - (1/2) d[H2O2] / dt
Je dérive x(t) par rapport à t :
dx/dt = - (1/2) d [nt (H2O2) ] / dt
Je ne comprend pas bien cela, pourriez-vous me l'expliquer ?
On a montré que :
x (t) = (1/2) ( n0 (H2O2) - nt (H2O2) )
donc
x(t) = n0(H2O2) / 2 - nt (H2O2) / 2
n0 (H2O2) est une constante dont la dérivée est nulle.
On a donc :
dx/dt = - (1/2) d (nt (H2O2) ) / dt
On a donc :
dx/dt = - (1/2) d (nt (H2O2) ) / dt
Je comprends pas bien comment on peut obtenir cela , en tout cas, merci pour votre aide
Revois ton cours de maths , on y apprend que
Si x = constante - g(t) alors
dérivée de x = 0 - dérivée de g(t)
En maths on écrirait cela x' = - g'(t)
En sciences physiques cela s'écrit dx/dt = - dg(t)/dt
Dans l'exercice présent g(t) est nt(H2O2)/2
On a x = constante - nt(H2O2)/2
donc dérivée de x =0 + dérivée de (-nt(H2O2)/2) = -(1/2) * dérivée de nt(H2O2)
Ce qui en physique s'écrit dx/dt = -(1/2) * d(nt(H2O2)) /dt


