Inscription / Connexion Nouveau Sujet
Cinétique chimique
Bonjour je m'appelle Sanna et je suis redoublante de terminale, j'ai un peu de mal sur cet exercice et je me demandais si vous pouviez m'aider merci !
Voici l'énoncé :
PARTIE A :
De nombreuses séries policières montrent des enquêteurs mettant en évidence, par pulvérisation d'un liquide, des taches de sang cachées : au contact du sang, une lumière bleutée brille dans l'obscurité.
Intriguées, deux élèves, Alice et Laure, cherchent à comprendre ce phénomène. Elles apprennent que le liquide pulvérisé est une solution de luminol et d'eau oxygénée. En se documentant, elles réunissent les informations suivantes :
« Le sang contient de l'hémoglobine dont un des constituants est un ion Fe2+. Le mélange de luminol et d'eau oxygénée ne produit pas de lumière bleue. Le mélange de luminol, d'eau oxygénée et d'ions Fe3+ produit une lumière bleue. »
Les deux élèves ne sont pas d'accord sur l'interprétation de ce phénomène. Alice pense que les ions Fe3+ sont des réactifs, tandis que pour Laure, ces ions sont des catalyseurs.
1)Expliquer pourquoi les 2 interprétations sont compatibles avec les informations trouvées.
2) Afin de se départager, les deux élèves décident de réaliser l'expérience correspondant au mélange de luminol, d'eau oxygénée et d'ions Fe2+. Elles constatent que les quantités de matière initiale et finale d'ions Fe3+ sont les mêmes. En déduire le rôle des ions Fe3+.
3) Montrer que les ions Fe2+ (apportés par l'hémoglobine) peuvent se transformer en ions Fe3+ en présence d'eau oxygénée (appelée aussi peroxyde d'hydrogène) en sachant que la réaction d'oxydoréduction fait intervenir le couple H2O2/H2O intervient. Dans cette réaction, les ions Fe2+ sont-ils réactifs ou catalyseurs ? Justifier en déterminant puis en exploitant l'équation de cette réaction.
4) Expliquer en quelques lignes pourquoi de la lumière est produite lorsque le mélange de luminol et d'eau oxygénée est pulvérisé sur du sang.
PARTIE B :
Alice et Laure s'intéressent à une autre réaction avec de l'eau oxygénée. Celle dont les ions iodure I avec de peroxyde d'hydrogène dont l'équation est :
H2O2(aq) + 2H+(aq) + 2I-(aq) —> 2H2O (l) + 2I2(aq)
Cette réaction est lente et totale, et de toutes les entités chimiques figurent dans la solution, seul le diiode est coloré.
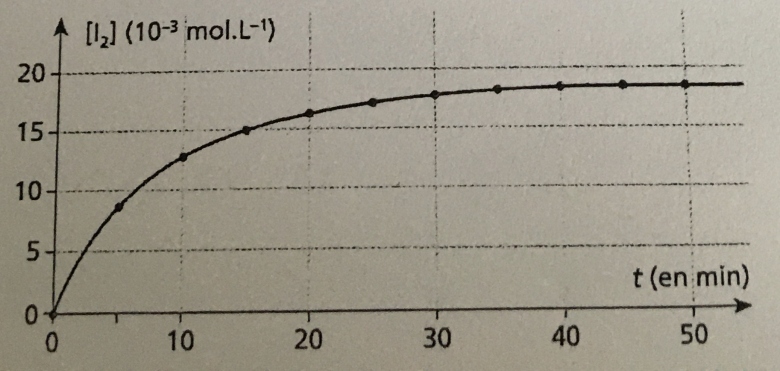
1)Quelle est la grandeur directement mesurable qui permet de suivre l'évolution de la réaction ? Comment varie-t-elle au cours de cette réaction ?
2)Estimer la durée de la réaction chimique. Justifier.
3)Définir de temps de demi-réaction de la réaction entre les ions iodure I- et le peroxyde d'hydrogène H2O2 puis le déterminer.
4)Sur le graphique ci-dessous, tracer l'allure de la courbe [I2] = f(t), si on garde le mélange initial et en augmentant sa température. Justifier.
Bonjour sannana,
Voilà un exercice très intéressant !
As-tu déjà quelques pistes? ou des points bloquants?
Il est important de nous dire ce que tu as fait/réussi à faire et ce qui te bloquent, pour qu'on puisse t'aider  .
.
Bon courage,
Metal Oxalate
Bonjour, normalement, je sais déterminer le temps de demi-réaction ainsi que la durée de la réaction chimique même s'il me faudra quand même peut être une vérification extérieure pour s'assurer que ce soit juste.
Sinon pour la question 1 je ne sais pas.
Et pour la 2, je dirais que le rôle des ions Fe3+ est un catalyseur ?
Pour la 1, je sais que la décomposition de l'eau oxygénée avec Fe3+ est une catalyse homogène ce qui me permettrait de dire que les ions sont des catalyseurs. Je sais aussi que lorsque le catalyseur est dans la même phase les réactifs, la catalyse est homogène ce qui me permettrait de dire que cela peut aussi être un réactif ?
Salut MetalOxalate ---> J'ai loupé ta réponse en lisant le topic, au temps pour moi ! Je te laisse prendre la main 
shadowmiko, pas de soucis. Merci  .
.
MetalOxalate:
Question 1:
-interprétation 1: les ions Fe3+ sont des réactifs
- interprétation 2: les ions sont des catalyseurs.
- Information: Le sang contient de l'hémoglobine dont un des constituants est un ion Fe2+. Le mélange de luminol et d'eau oxygénée ne produit pas de lumière bleue. Le mélange de luminol, d'eau oxygénée et d'ions Fe3+ produit une lumière bleue.
--> Quelle est la couleur du mélange eau oxygénée + luminol?
--> Du coup, Fe3+ peut-il être un ion spéctateur?
--> Peut-il être un réactif?
--> Est-ce que toute espèce non spectatrice est forcément un réactif?
--> Du coup, peut-il aussi être un catalyseur?
Question 2:
Oui, très bien. C'est un catalyseur.
La couleur du mélange eau oxygénée + luminol est transparente.
Non Fe3+ ne peut pas être un ion spectateur car il est responsable de la coloration.
Oui il peut être un réactif.
Oui, toute espèce non spéctatrice est forcément un réactif.
Donc oui, il peut aussi être un catalyseur !
"Oui, toute espèce non spéctatrice est forcément un réactif."
 !
!
Une espèce non-spectratrice peut être autre chose qu'un réactif.
Par exemple, un produit ou un catalyseur.
Bref, tu as compris le raisonnement ? 😊
Question 3:
Comment montrer qu'une réaction est possible ?
Quelle grandeur thermodynamique nous est utile ?
Bon courage,
Metal Oxalate
Oui, j'ai bien compris le résonnement merci 
Pour montrer qu'une réaction est possible, il faut qu'il y ai un changement de la matière ? Une transformation.
Et je dirais que la grandeur thermodynamique qui nous est utile est la température non ? Enfin, c'est ce à quoi me fait penser le terme "thermodynamique"
L'énoncé doit donner les poyentiels redox (E0).
Comment doit être E0Fe2+/Fe3+ par rapport à E0H2O2/H2O pour que la réaction soit possible ? ☺️
Pas de problème sannana ☺️.
Le potentiel redox standard (E0) caractérise le pouvoir Oxydant ou Reducteur d'une espèce chimique dans les conditions standards (Pression atmosphérique, T = 25°C).
Plus E0 est grand, plus l'espèce est oxydante.
Plus E0 est faible, plus l'espèce est réductrice (E0 peut être négatif).
E0 s'exprime en V (Volt) et est defini par rapport à un potentiel de référence (c'est en fait une différence de potentiel [une tension] que l'on mesure). En général, on prend pour référence une électrode normale à hydrogène (ENH) qui correspond au couple H+/H2.
Ainsi, par convention, E0H+/H2 = 0.
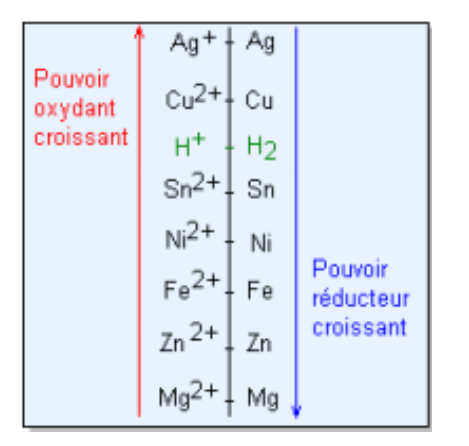
On peut alors construire un axe de potentiel (cf. Image) et y placer les couples présents.
Les oxydants sont mis à gauche de l'axe, les réducteurs à droite.
Te souviens-tu de la règle du gamma pour les couples acide/base? Et bien elle marche aussi pour les couples redox, avec une échelle redox 😉.
Bref ! Pour qu'une réaction ait lieu, il faut que le potentiel standard redox de l'espèce oxydante (H2O2) soit supérieur à celui de l'espèce réductrice (Fe2+).
Est-ce le cas ici ?
Conclure quant à la faisabilité de la réaction 😊.
As-tu des questions ?
Metal Oxalate
Oui, c'est le cas ici : le potentiel standard redox de l'espèce oxydante (H2O2) est bien supérieur à celui de l'espèce réductrice (Fe2+).
C'est bien ça ?
Ca voudrait dire que H2O2 est un oxydant ?
Et dans cette réaction les ions Fe2+ sont des réactifs ?
Si tout cela est juste, je ne sais pas comment déterminer et exploiter l'équation de cette réaction ?
En tout cas, merci beaucoup de m'aider 
Très bien sannana, tu as tout compris.
Comme le potentiel du couple H2O2/H2O est plus élevé que celui du couple Fe3+/Fe2+, la réaction d'oxydation qui a lieu est: Fe2+ et H2O2 donne Fe3+ et H2O.
De plus, comme l'équation bilan fait intervenir Fe2+ dans les réactifs (à gauche du signe égal), mais pas à droite. Fe2+ est donc consommé, mais pas régénèré. C'est donc bien d'un réactif 😊.
Pour équilibrer cette réaction:
- il faut d'abord équilibrer les demi équitation :
Fe2+ = Fe3+ + ...
Et
H2O2 + ... + ... = ...H2O
-Puis rassembler les demi équations de manière à avoir autant d'électrons (e-) à droite qu'à gauche (on pourra donc les effacer).
Bon courage !
Metal Oxalate
Sinon pour la partie B :
1) Je pense que la grandeur directement mesurable qui permet de suivre l'évolution de la réaction est la température.
Elle augmente au cours du temps.
2) La durée de la réaction chimique est d'environ 55 minutes.
3) Le temps de demi-réaction de la réaction est 5 minutes ? (déterminé graphiquement).

Fe2+ = Fe3+ + e-
Oui, très bien !
H2O2 + 4H+ = 3H2O + 4e-
Tu as 2 oxygène à gauche / 3 à droite
4 charge + à gauche/ 4 charge + à droite
Cette démi équation n'est pas équilibré.
Rappel sur l'équilibrage des réactions redox:
1 - équilibrer les atomes autres que O et H
2 - équilibrer l'oxygène oxygène avec des molécules d'eau
3- équilibrer l'hydrogène avec des ions H+;
4- équilibrer les charge en rajoutant des électrons (e−).
Et pour la question 4 de la partie A, que proposes-tu ? ☺️
Expliquer en quelques lignes pourquoi de la lumière est produite lorsque le mélange de luminol et d'eau oxygénée est pulvérisé sur du sang.
Bon courage
Concernant la partie B:
1) Je pense que la grandeur directement mesurable qui permet de suivre l'évolution de la réaction est la température.
L'énoncé nous donne un graphique I2 = f(t). Il nous faut donc un moyen simple de mesurer la concentration de I2.
Comme on ne peut pas relier la concentration de I2 à la température, ce n'est pas T.
L'énoncé nous dit par contre que I2 est la seule espèce colorée du milieu réactionnel...
2) La durée de la réaction chimique est d'environ 55 minutes.
Comment as-tu trouvé ce résultat ?
Quel raisonnement as-tu suivi ? ☺️
3) Le temps de demi-réaction de la réaction est 5 minutes ? (déterminé graphiquement).
Oui, très bien !
Remarque : l'énoncé demande aussi de définir le temps de demi-réaction. Si c'est un devoir maison, n'oublie pas de répondre à cette question 😊.
Bon courage,
Metal Oxalate
Pour la 3) de la partie A, je dirais :
H2O2 + 2H+ + 2e- = 2H2O

4) De la lumière est produite lorsque le mélange de luminol et d'eau oxygénée est pulvérisé sur du sang car cela produit des ions Fe3+ qui sont des catalyseurs et qui sont responsables de la coloration.
PARTIE B :
1) Je pense que la grandeur directement mesurable qui permet de suivre l'évolution de la réaction est la concentration ou la couleur non ?
2) J'ai trouvé ce résultat sur le graphique car la courbe devient stable vers les 55min
3) Le temps de demi-réaction est le temps où la concentration du réactif a diminué de moitié.
Pour la 3) de la partie A, je dirais :
H2O2 + 2H+ + 2e- = 2H2O
Bravo, c'est ça !
4 H, 2O et charge neutre des 2 côté ☺️
Maintenant, que tu as les 2 demi équations, peux-tu les rassembler pour en faire une usique équation bilan ? ☺️
4) De la lumière est produite lorsque le mélange de luminol et d'eau oxygénée est pulvérisé sur du sang car cela produit des ions Fe3+ qui sont des catalyseurs et qui sont responsables de la coloration.
Il y a de l'idée, mais c'est trop vague.
- qu'est-ce qui produit des ions Fe3+?
- C'est vrai que Fe3+ est un catalyseur, mais cette info n'est pas utile ici ☺️. On va donc alléger la phrase.
- en quoi les ions Fe3+ sont responsables de la coloration ? ça c'est important.
PARTIE B :
1) Je pense que la grandeur directement mesurable qui permet de suivre l'évolution de la réaction est la concentration ou la couleur non ?
Presque..! C'est l'absorbance que l'on mesure. Et avec l'absorbance on trouve la concentration (loi de beer Lambert).
2) J'ai trouvé ce résultat sur le graphique car la courbe devient stable vers les 55min
Ce qui me gène, c'est que ton graphe ne va pas jusqu'à 55min...
Quelle est la concentration à 40min? 45min? 50min?
En déduire la réponse à la question 2
 .
.
3) Le temps de demi-réaction est le temps où la concentration du réactif a diminué de moitié.
Très bien 😁! C'est ça.
Tu as toutes les cartes en main et les capacités pour réussir cet exercice.
Bon courage Sannana!
Metal Oxalate
Pour l'équation bilan j'ai trouvé :
H2O2 + 2H+ + 2Fe2+ = 2H2O + 2Fe3+
4) Les ions Fe2+ produisent les ions Fe3+
Les ions Fe3+ sont responsables de la coloration car le sang contient de l'hémoglobine et que les ions Fe2+ (qui produisent les ions Fe3+) sont apportés par l'hémoglobine.
2) A 40 minutes : environ 17.5
A 45 minutes : environ 17.5
A 50 minutes : environ 17.5
Donc, la durée de la réaction est de 40 minutes !
Merci Beaucoup en tout cas !
Maintenant, si tout est correct, il ne me reste plus qu'à tracer l'allure de la courbe (Q4) mais je ne sais pas trop ce que ça veut dire ? 



