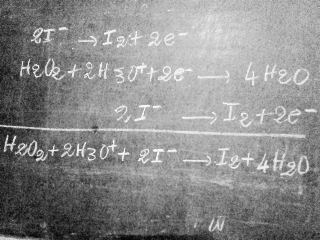Inscription / Connexion Nouveau Sujet
cinétique
bonsoir, j'ai un petit problème. aidez-moi s'il vous plaît .
professeur mélange à froid une solution S1 d'eau oxygénée une solution S2 d'acide sulfurique une solution stradiot de potassium et de l'eau distillée pour obtenir solution s
pourquoi la solution s et préparer à froid
la solution d'iodure de potassium et non stradiot
la question c'est : pourquoi la solution s est préparé à froid
Bonsoir
Impossible de t'aider efficacement sans un énoncé complet.
Tu dois savoir que la vitesse de réaction augmente très rapidement avec la température. Maintenir le mélange réactionnel très froid rend la vitesse de réaction quasi nulle. Une température faible empêche pratiquement la réaction de se dérouler.
Sous toute réserve ; sans énoncé complet...
contexte
au cours d'une séance de travaux pratiques au laboratoire un professeur de pct à étudier avec ses apprenants la cinétique de la réaction de l'eau oxygénée ou peroxyde d'hydrogène sur les ions iodure en milieu acide et enfin ils ont identifié une solution aqueuse dont le flacon a perdu son étiquette par dosage de celle-ci. à la fin des expériences les élèves veux savoir : pourquoi la solution S est préparer à froid ? pourquoi chaque tube est trempée avant son dosage ? pourquoi a-t-on ajouté de l'emploi d'amidon au contenu de chaque tube avant le dosage du diiode.
support
étude cinétique de la réaction entre l'eau oxygénée et les ions iodure
pour cette étude le professeur mélange à froid une solution S1 d' eau oxygénée une solution S2 d'acide sulfurique une solution S3 d'iodure de potassium et de l'eau distillée pour obtenir une solution S ensuite il est parti sa solution est dans le tube à essai les dit ils sont placés dans un bain thermostaté à la température ambiante à un instant considéré comme initial par intervalle de temps un tube est sorti et trempé à son contenu on ajoute de l'emploi d'amidon en essai et le diiode formée est osé par une solution de thiosulfate de sodium
J'ai déjà répondu concernant l'influence des basses températures.
L'empois d'amidon introduit en très faible quantité donne à la solution une coloration bleue très intense en présence de diiode. Il joue ici le rôle d'indicateur coloré.
1-1-établir l'équation bilan de la réaction entre des ions iodure et l'eau oxygénée
1-2- proposer une réponse aux questions soulevées par les élèves à la fin de l'expérience sur la cinétique de la réaction d'oxydation des ions iodure et de l'eau oxygénée

Pour la réaction d'oxydo réduction, on te fourni les deux couples oxydant réducteur. Je ne connais pas ton programme mais le plus simple consiste sans doute à écrire d'abord les deux demies réactions.
Je te laisse réfléchir et proposer une solution.
et pour la préoccupation numéro 2 des élèves :pourquoi chaque tube est trempée avant son dosage
1-3 identifier le réactif en défaut à l'instant initial entre H30+; I-;H202 et en déduire la concentration maximale {I2}max qui pourrait se former
2-
2-1-écrire l'équation bilan de la réaction de dosage du diiode par les ions thiosulfate.
2-2- montrer que la concentration molaire du lait santé à pour expression {I2}t= (C4V4)/(2Vo) avec V4 le volume de la solution de thiosulfate de sodium nécessaire à chaque dosage
Ok pour la réaction dont on étudie la cinétique. À différentes dates on bloque la réaction par ajout d'eau froide. On ajoute un peu d'empois d'amidon, la solution vire au bleu intense. On dose alors le diiode formé par une solution de thiosulfate de sodium. L'équivalence correspond à la disparition de la couleur bleue.
Il faut aussi écrire l'équation de cette réaction.
Essaie d'écrire l'équation plutôt que de scanner une image.
Pas facile au début d'écrire des formules ! Merci d'avoir fait l'effort et je pense que tu as compris. 
Pour la réaction dont on étudie la cinétique, I2 est un produit, pas un réactif. Tu peux calculer les quantités introduites des trois réactifs puis conclure en tenant compte des coefficients stoechiometriques de l'équation bilan.
Aucune raison de diviser par 2 c3v3. Il faut faire les applications numériques puis tenir compte des coefficients stoechiometriques.
n1=2,8×10^-2×100×10^-3= 2,8×10^-3mol
n2=6×10×10^-3= 6×10 ^-2mol
n3=0,25×80×10^-3=2,4×10^-2mol
en tenant compte des coefficient stoechiométrique nous avons:
n1<(n3/2)<n2/2 d'où H202 est le réactif en défaut
Oui et la quantité maximale de diiode susceptible de se former est égale à la quantité de H2O2 introduite.
si pouvez me confirmer à chaque fois de la véracité ou non de ce que je fais, j'en serai ravi. merci quand même pour votre aide