Inscription / Connexion Nouveau Sujet
Cinétique
Bonsoir, voici mon énoncé:
Soit l'équation de la dimérisation: 2NO2 (g) = N2O4 (g)
La variation de 1/[NO2] (L. mol-1) est données ci dessous: (schema)
On me dis que le temps de demi réaction est t(1/2) = 100 min
Je sais que le temps de demi réaction est le temps qu'il faut pour que la moitié de la réaction ai lieu.
Mais je n'arrive pas à comprendre que l'on puisse dire que le temps de demi réaction ici soit de 100 min au lieu de 50 min.
Pouvez vous m'expliquer? Merci et bonne soirée.
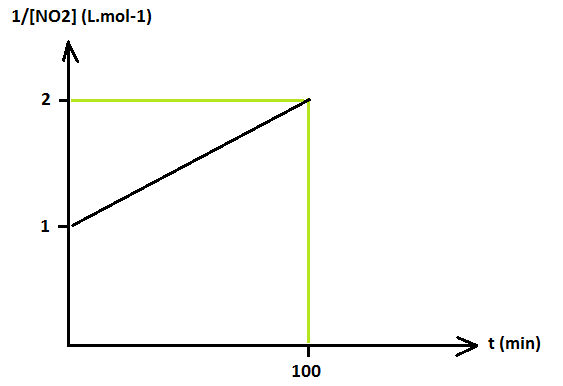
Cette représentation est caractéristique d'une cinétique d'ordre 2.
De manière générale, la solution (1) est
k : constante de vitesse
[A] = [NO2]
: coef stoechiométrqiue, ici
pour le temps de demi réaction
en reportant dans (1)
Donc le temps de demi réaction sera atteint quand la concentration en [NO2] sera égale à 2 fois l'inverse de la concentration initiale.
Ici


