Inscription / Connexion Nouveau Sujet
Dac
cVé/4=c0V/(5*100)
Donc si je comprends bien, à l'équivalence on peut écrire pour les exemples du dessous :
n(étha)/8=n(perman)/7
ou encore
n(étha)=n(perman)/9
de manière systématique?
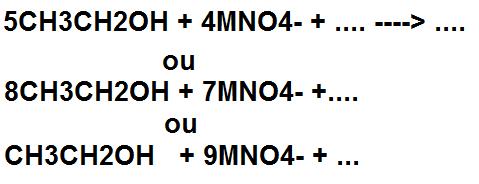
Je comprends je comprends 
calcul de Vé :
cVé/4=c0V/(5*100)
soit Vé = c0V*4/(c*500)
Vé = 0,0137 L = 13,7 mL !
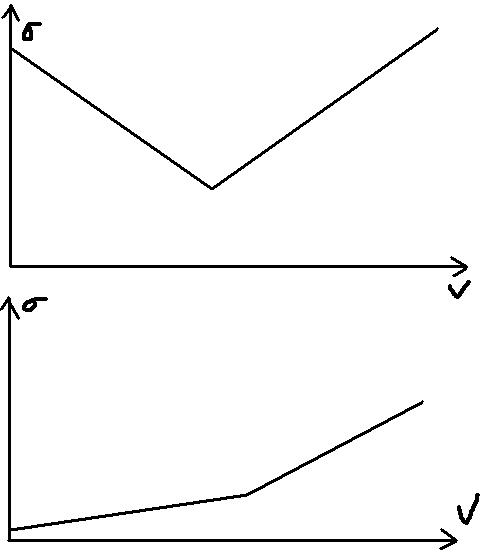
On te demande l'allure, non ? Donc pas besoin de placer des "points". Il faut simplement se demander quand est-ce que la conductivité de la solution va augmenter et quand est-ce qu'elle va diminuer. En sachant, de plus, que le volume équivalent correspond à l'abscisse du point où se fait la rupture de pente.
Les questions à se poser sont les suivantes :
(*) quelles sont les espèces responsables de la conductivité de la solution ?
(*) parmi elles, lesquelles sont présentes avant l'équivalence ? et après l'équivalence ?
(*) que valent leurs conductivités molaires ioniques ?
Les ions sont responsables de la conductivité de la solution, plus la conductivité molaire ionique d'un ion est élevée, mieux l'ion conduit.
avant l'équivalence dans le bécher sont présents les ions : Cl-et H+ de l'acide chlorhydrique et les ions Mn2+
après on a des ions H+, Cl-, Mn2+ et aussi MnO4-
ces derniers conduisent bien
Avant l'équivalence, on consomme des ions oxonium qui ont une très grande conductivité molaire ionique, on apporte potassium et ils se forment des ions manganèse sauf que ces derniers ont des conductivités molaires ioniques bien moins élevées que celle des ions oxonium donc une diminution de la conductivité.
Après l'équivalence, on ne fait que rajouter des ions potassium et des ions permanganate d'où une augmentation de la conductivité.
La rupture de pente nous permet avant de déterminer le volume équivalent 
ben eux ils sont présent avant et après l'équivalence, ils sont spectateurs comme les ions Cl-
Certes, mais je t'ai demandé de faire un bilan sur qui est présent avant et après l'équivalence et tu les avais oubliés !
Oui je les avais oubliés..
Donc
avant l'équivalence dans le bécher sont présents les ions : Cl-et H+ de l'acide chlorhydrique et les ions Mn2+ et K+
après on a des ions H+, Cl-, Mn2+ et aussi MnO4- etK+
ça doit être complet 
Voilà, c'est complet cette fois.
Pourquoi précises-tu "de l'acide chlorhydrique" ? Pour les ions permanganate et potassium, tu n'as pas précisé "de la solution de permanganate de potassium" ! Bref... 
Une dernière remarque : d'après notre discussion d'hier sur H+ et H3O+, il serait plus correct d'écrire H3O+ ici. En effet, on est en solution aqueuse, donc les protons sont hydratés...
Ah, je ne pensais pas à l'équation de la réaction de titrage, mais tu as raison. Tu rajoutes H20 à droite et à gauche de ton équation de la réaction : à gauche H+ + H2O deviennent H3O+ et à droite tu as H2O en plus.
Tu parles de la question 2 ou de la 4?
De plus, ça va changer les coef stoechiométriques et donc Vé aussi 
Ta, ta, ta !
À la question 2, il s'agit d'une demi-équation donc laisse H+.
Je parlais de la question 4. Et non, ça ne va pas changer TOUTE la stchiométrie de la réaction, uniquement celle de H2O ! Tu as 12H+ à gauche, donc si tu rajoutes 12H2O à gauche et à droite ça te fait apparaître 12H3O+ à gauche et tu passes de 11 à 23H2O à droite : ça ne modifie donc pas les nombres stchiométriques des autres espèces !
Mais bon, ça c'est du chipotage donc laisse comme ça si tu le souhaites.
Tu peux écrire l'équation de titrage que ça ferait? Ca serait sympatoche :/
Donc en fait, après l'équivalence les ions MnO4- sont en excès (le seul changement qu'il y a) (on peut le dire comme ça?) et comme ils conduisent bien, la conductivité augmente en fonction de V.
Ben si tu pars de et que tu ajoutes
à gauche comme à droite, tu obtiens :
. Quel est le souci ?!
Donc en fait, après l'équivalence les ions MnO4- sont en excès (le seul changement qu'il y a) (on peut le dire comme ça?) et comme ils conduisent bien, la conductivité augmente en fonction de V.
Ce n'est pas le seul changement : lorsque tu apportes des ions permanganate, tu apportes également des ions potassium avec ! Or les concentrations des autres ions en solutions restent inchangées après l'équivalence, donc la conductivité augmente.
avant l'équivalence, on ajoute des K+ donc  augmente
augmente
après équivalence, les MnO4- ne sont plus consommés et restent donc  augmente
augmente
et encore plus car MnO4- conduisent mieux.
Or les concentrations des autres ions en solutions restent inchangées après l'équivalence
Pourquoi? Le volume augmente non?
Citation :
Or les concentrations des autres ions en solutions restent inchangées après l'équivalence
Pourquoi? Le volume augmente non?
Pardon, je n'ai pas fait attention à ce que je disais. M'enfin, sachant que le volume est de 100mL, quand tu rajoutes quelques millilitres, la variation de concentration n'est pas très importante.
avant l'équivalence, on ajoute des K+ donc augmente
Attention ! Tu ne prends pas en compte les autres ions. N'y aurait-il pas des ions oxonium qui seraient consommés par hasard ?
Relis ce que j'avais répondu plus haut :
Avant l'équivalence, on consomme des ions oxonium qui ont une très grande conductivité molaire ionique, on apporte des ions potassium et ils se forment des ions manganèse sauf que ces derniers ont des conductivités molaires ioniques bien moins élevées que celle des ions oxonium donc une diminution de la conductivité.
Après l'équivalence, on ne fait que rajouter des ions potassium et des ions permanganate d'où une augmentation de la conductivité.
La rupture de pente nous permet avant de déterminer le volume équivalent

Ben le fait de consommer des ions oxonium (de très grande conductivité molaire ionique) entraîne une augmentation de la conductivité, non ? Elle pourrait augmenter cette la diminution d'ions oxonium était compensée par l'apparition d'ions très conducteurs. Mais, ici, on apporte des ions potassium dont la conductivité molaire ionique n'est pas très élevée...
N'es-tu pas d'accord ?
Ben le fait de consommer des ions oxonium (de très grande conductivité molaire ionique) entraîne une diminution de la conductivité
plutôt non?  on s'emmèle tout !
on s'emmèle tout !
Donc c'est bien un truc comme la première courbe que je dois tracer 
C'était un lapsus, en effet : il fallait lire entraîne une "diminution".
À mon sens, la courbe ressemble à la première que tu as postée : diminution puis augmentation de la conductivité (avec repérage du volume équivalent à la rupture de pente).
Dac !
Donc je pars d'une conductivité au hasard et je fait les pentes au hasard.
L'abscisse de la rupture de la pente correspond à Vé = 13,7 mL 
On te demande l'allure, donc tu n'as pas à placer de points précis.
Il faut simplement traduire le fait que la conductivité diminue puis augmente.
Oui, indique Vé à l'abscisse du point où il y a rupture de pente mais ne met pas de valeur (on te dit de travailler avec une autre valeur de Vé en plus à la question suivante).
6)Je pense qu'il faut résoudre une équation.
11,7 = 2,06*10.10-V*4/(1,20.10-2*500)
mais celle ci relève du grand n'importe quoi : pas d'inconnue 
Dans mon message du 24/02 à 15:39, j'avais écris :
c0=(d
 eauV')/(MV).
eauV')/(MV).
Or, dans un volume V de vin, il y a un volume V'=DV où D=0,120 est le degré alcoolique du vin (petit produit en croix : si 100mL de vin correspond à 12,0mL d'éthanol, alors un volume V de vin correspond à un volume V'=0,120V d'éthanol).
On a donc
De plus, a on
Tu peux donc déterminer l'expression de
 ).
).Mais on a que cette expression dans laquelle apparait Vé !
As-tu vu mon message de 18:45 ?
pas d'inconnue
D'ailleurs, comment ça pas d'inconnue ?!
c0 en est une !
En effet, comment a-t-on déterminé c0 à la question 1 ? En utilisant le degré alcoolique indiqué sur l'étiquette de la bouteille...
Or c'est justement ce que l'on veut vérifier ! D'où le titrage réalisé pour déterminer la valeur réelle de c0 et donc de D.
En effet j'aurais du m'en rendre compte !
11,7.10-3 = c0*10.10-3*4/(1,20.10-2*500)
c0 = 1,75 mol/L
et c0 = d eauV'/(MV) avec V' l'inconnue
eauV'/(MV) avec V' l'inconnue
et je trouves V' = 0,0102 L soit 10,2 mL
Donc le degré réel du vin est 10,2° 
Je vois ça.
Hé bien, on sera arrivés au bout de cet exo.
Je te remercie énormément de tout ce temps passé à m'expliquer, et bien expliquer car j'ai tout compris. 
Oui, sauf qu'il faut que je reprenne cet exo qui est encore un peu flou pour moi : https://www.ilephysique.net/sujet-physique-237652.html