Inscription / Connexion Nouveau Sujet
Chimie vitesse de reaction
Bonjour
Ils proposent un graphe donc je le mets ici ***Lien supprimé***
1- pv=n0.rt => no=pv/rt => no=4.638*10^4/8.314*318
2- 2Xm=no => Xmax=no/2 => Xmax=(4.638*10^4/8.314*318)/2
3- Je ne trouve pas de solution
4- P/Po=(xrt/v)/(no.rt/v) = x/no +1
5- Je bloque ici également
Pouvez-vous me guider un peu ?
***Un énoncé est à recopier intégralement ; pour le schéma, l'insérer avec le bouton "Img" en-dessous du cadre dans lequel tu écris***
Bonjour
Enonce
Les oxydes (NO2-NO-...) sont considérés parmi Ses polluants principaux de l'atmosphère à cause de leur participation dans la formation des pluies acides qui sont nocive pour l'environnement d'une part et l'augmentation de l'effet de serre d'autre part
L'objectif de cet exercice est d'étudier ia cinétique de la dissociation du pentaoxyde Nabote N2O5 en NO2 ci O2
Données : On considère que tous les gaz sont parfaits - La consianle des gaz parfaits : R =8.31 (S.l) - l'équation d'état des gaz parfaits : PV=nRT
On met du pentaoxyde de diazote dans une enceinte initialement vide devolume eonsianl V=0,50L unie d'un baromètre pour mesurer la pression tout le P l'intérieur tie r enceinte à une température T=318K
On mesure au début de la dissociation (t=0) à l'intérieur de l'enceinte la pression totale: on trou alors p0=4.638x10^5 Pa . Le pemaoxydc de diazotc se dissocie scion une réaction lente et totale 2N2O5(g) -> 4NO2(g) + O2(g)
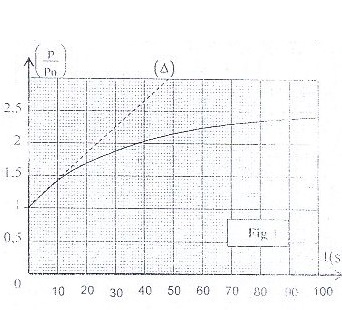
On mesure la pression P à différents instants ci représente la variation de la grandeur p/p0 en fonction du temps, on obtient le graphe représenté dans la fig 1. La droite ( A )
représente la tangente à la courbe p/p0=f(t) à rinstant t=0.
1- Calculer la quantité de matières n0 du pentaoxyde de diazolc dans le volume V à t=0 .
2- Calculer l'avancement xmax de cette réaction.
3- Exprimer nt la quantité de matière totale des gaz dans le volumes v à l 'instant t en fonction de n0 et x l'avancement de la réaction
4- En appliquant l'équation d'état des gaz. parfaits, établir ià relation p/p0=1+3x/n0
Trouver l 'expression de la vitesse volumique de la réaction en fonction de n \> v et la dérivée par rapport au temps de la fonction p/p0=f(t) .Calculer sa valeur à t=0
Solution
1- pv=n0.rt => no=pv/rt => no=4.638*10^4/8.314*318
2- 2Xm=no => Xmax=no/2 => Xmax=(4.638*10^4/8.314*318)/2
3- Je ne trouve pas de solution
4- P/Po=(xrt/v)/(no.rt/v) = x/no +1
5- Je bloque ici également
Pouvez-vous me guider un peu ?
*** message déplacé ***
Solution
1- pv=n0.rt => no=pv/rt => no=4.638*10^4/8.314*318
OK pour n0 = PV/RT
Le calcul numérique me semble faux mais
- Il n'est pas terminé
- Il n'a pas d'unité !
*** message déplacé ***

 :
:

 ) :
) :

