Inscription / Connexion Nouveau Sujet
chimie minerale
Bonjour
Dans un Becher ,on introduit Vb =20 ml d une solution aqueuse d ammoniac de concentration C inconnue.A l aide d une burette graduée ,on y ajoute un volume V(en ml) d une solution d acide chlorhydrique de concentration C'=0,14 mol/l puis on mesure au fur et a mesure le pH du mélange.on obtient alors le tableau de mesures suivantes:
1/écrire l équation bilan de la réaction acide basique
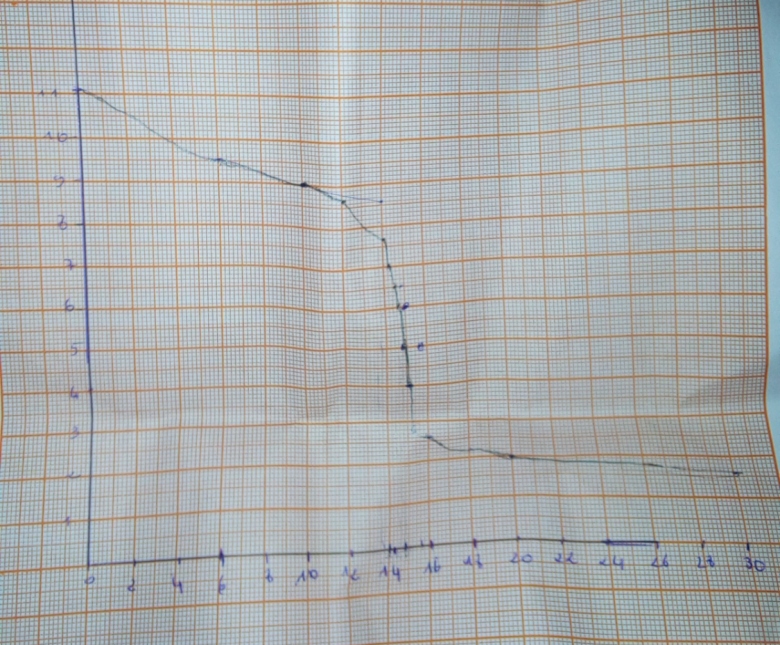
2/trace la courbe pH=f(V)
Échelle :
1cm =>2 ml et 1 cm=> une unité de PH.
3/déduis de cette courbe:
3/1les coordonnées du point d équivalence.
3/2 .la valeur du pKa du couple concerné.
3/3.la concentration C de la solution d ammoniac
3/4.pourquoi la solution est acide a l équivalence
Réponse
Question 1
NH3 + H3O ==>NH4 + H2O
Voici le tableau

Bonjour
Question 1 :
To équation est à revoir
Question 3 :
Fais la liste des espèces chimiques présentes lorsque le point d'équivalence est atteint et répond à la question posée à partir de cette liste.
Question 1
NH3 + H3O^+ ===> NH4^+ + H2O
Question 3
La liste des espèces chimiques sont:
NH3, H3O^+, NH4^+ , H2O
D'après le résultat de la question 1, à l'équivalence les ions H3O+ amenés par la solution d'acide chlorhydrique ont réagi avec la totalité des molécules de NH3 initialement présentes.
La réaction a produit des ions NH4+ et elle contient les ions Cl- apportés par la solution d'acide chlorhydrique.
Il en résulte que lorsque l'équivalence est atteinte la solution est une solution de chlorure d'ammonium (NH4+ + Cl-) c'est à dire une solution d'acide faible, puisque l'ion ammonium est l'acide conjugué de NH3
La solution étant acide, il est normal que son pH soit inférieur à 7
Questions 3.1 et 3.2 :
Les réponses se lisent sur la courbe pH=f(V). Revoir le cours si nécessaire.
Question 3.3
A l'équivalence la quantité d'acide chlorhydrique introduite par l'intermédiaire de la burette est égale à la quantité de NH3 intialement présente dans le bécher.
Un calcul très simple permet de répondre à la question posée.
Question 3.1 :
La question porte sur les coordonnées du point d'équivalence.
Ce point possède deux coordonnées qui doivent être précisées toutes les deux.
Questions 3.1 et 3.2 :
Compte tenu de la mauvaise qualité de la courbe pH=f(V) publiée le 03-06-20 à 16:57 ainsi que de l'absence de justifications, de l'absence d'unité pour VAE, je ne suis pas en mesure d'apprécier la qualité des résultats que tu proposes.
Pour la courbe il suffit d'y apporter davantage de soin.
Une courbe n'est pas une suite de segments.
Pour les justifications et pour les unités c'est à toi de compléter.