Inscription / Connexion Nouveau Sujet
chimi une reaction n'est pas toujours totale
bonjour, je dois etudier un tp de chimi mais je bloc a certain endroit voila l'énoncé
on etudie la transformation entre un acide de formule générale r-cooh et l'eau. On connait la concentration apportée en acide noté c. Une mesure de conductivité permet de connaitre la concentration en ions H3O+ de la solution.
A)1.ecrire l'equation de la relation associé à la transformation entre l'acide r-cooh et l'eau.les couples sont r-cooh/r-coo- et H3O+/H2O
2.établir le tableau d'avancement
3.quels sont les ions responsables de la conductivité de la solution ?
4.etablir l'expression de cette conductivité en fonction de la concentration final [H3O+]f en ions oxonium puis l'expression de la concentration final en ions oxonium en fonction de la conductivité de la solution.
B)
On définit le taux d'avancement t d'une reaction comme le rapport entre l'avancement à l'equilibre et l'avancement maximal. t=xeq/xmax (nombre sans unité)
etablir l'expression du taux d'avancement de la réaction éudiée en fonction de la concentration final en ions oxonium et de la concentration apportée en acide.
Quelle est la valeur de ce taux d'avancement quand la reaction et totale?
Dans quel intervalle est comprise sa valeur quand la reaction n'est pas totale?
C)
on définit le quotient de réaction à l'équilibre (Qreq) pour une equation donnée:
aA + bB = cC + dD
A,B,C,D étant des solutés d'une solution acqueuse dilué; a,b,c et d étant les coefficients stoechiométriques de l'equation.
comme le rapport Qreq: Qreeq= [C]eq^c * [D]eq^d / [A]eq^a * [B]eq^b (^=puissance *= fois)
Les différentes concentrations à l'équilibre sont exprimées en mol/L. L'eau etant dans ces solutions le solvant, elle n'intervient, elle n'intervient pas dans le quotient de réaction même si elle apparait dans l'equation.
1.Exprimer le quotient de réaction à l'équilibre correspondant à l'equation de la réaction étudiée.
2.etablir son expression en fonction de la concentration finale en ions oxonium et de la concentration apportée en acide.
voila l'enoncé est un peu long mais les reponse sont plus courte.J'ai essayé de le fair mais je suis pa du tout sur de mes reponses. merci aux personnes qui m'aideront

salut:
A) l'equation de la relation associé à la transformation entre l'acide R-COOH et l'eau.les couples sont R-COOH/RCOO- et H3O+/H2O
RCOOH+H2O = RCOO- + H3O+
2. le tableau d'avancement
RCOOH+H2O = RCOO- + H3O+
CV excès 0 0
cv-x ... x x
3) les ions responsables de la conductivité de la solution sont : H3O+ et RCOOH.
 =
= RCOO- .[RCOO-]+
RCOO- .[RCOO-]+ H3O+ .[H3O+]
H3O+ .[H3O+]
or [RCOO-]=[H3O+]
 =(
=( RCOO- +
RCOO- + H3O+) .[H3O+]
H3O+) .[H3O+]
B)
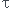 =xeq/xmax
=xeq/xmax
d'après le tableau:
cv-xmax=0 => xmax=cv
l'expression du taux d'avancement de la réaction éudiée en fonction de la concentration final en ions oxonium et de la concentration apportée en acide est.
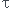 =
=
la valeur de ce taux d'avancement quand la reaction et totale. =>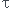 +1.
+1.
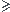 1
1
erreur de tappe:
valeur de ce taux d'avancement quand la reaction et totale. =>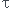 =1
=1
l'intrvalle dont est comprise sa valeur quand la reaction n'est pas totale:
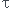
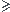 1
1
]aaaaaaaaaaaaaaaaaaaaa
qu'est ce que je raconte là haut.
l' intervalle du tau d'avancement quand la reaction n'est pas totale est:
1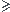
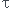
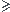 0
0
C)
on définit le quotient de réaction à l'équilibre (Qreq) pour une equation donnée:
aA + bB = cC + dD
A,B,C,D étant des solutés d'une solution acqueuse dilué; a,b,c et d étant les coefficients stoechiométriques de l'equation.
Les différentes concentrations à l'équilibre sont exprimées en mol/L. L'eau etant dans ces solutions le solvant, elle n'intervient, elle n'intervient pas dans le quotient de réaction même si elle apparait dans l'equation.
merci pour tes reponse 122155 javais trouvé les meme resultat pour le A et le B je blokai pour le taux d'avancement tu ma vraiment aidé mais je ne comprend pa du tout la parti C avec Aa,Bb,Cc et Dd
bonjour, je dois etudier un tp de chimi mais je bloc a certain endroit voila l'énoncé
on etudie la transformation entre un acide de formule générale r-cooh et l'eau. On connait la concentration apportée en acide noté c. Une mesure de conductivité permet de connaitre la concentration en ions H3O+ de la solution.
A)1.ecrire l'equation de la relation associé à la transformation entre l'acide r-cooh et l'eau.les couples sont r-cooh/r-coo- et H3O+/H2O
2.établir le tableau d'avancement
3.quels sont les ions responsables de la conductivité de la solution ?
4.etablir l'expression de cette conductivité en fonction de la concentration final [H3O+]f en ions oxonium puis l'expression de la concentration final en ions oxonium en fonction de la conductivité de la solution.
B)
On définit le taux d'avancement t d'une reaction comme le rapport entre l'avancement à l'equilibre et l'avancement maximal. t=xeq/xmax (nombre sans unité)
etablir l'expression du taux d'avancement de la réaction éudiée en fonction de la concentration final en ions oxonium et de la concentration apportée en acide.
Quelle est la valeur de ce taux d'avancement quand la reaction et totale?
Dans quel intervalle est comprise sa valeur quand la reaction n'est pas totale?
C)
on définit le quotient de réaction à l'équilibre (Qreq) pour une equation donnée:
aA + bB = cC + dD
A,B,C,D étant des solutés d'une solution acqueuse dilué; a,b,c et d étant les coefficients stoechiométriques de l'equation.
comme le rapport Qreq: Qreeq= [C]eq^c * [D]eq^d / [A]eq^a * [ B]eq^b (^=puissance *= fois)
Les différentes concentrations à l'équilibre sont exprimées en mol/L. L'eau etant dans ces solutions le solvant, elle n'intervient, elle n'intervient pas dans le quotient de réaction même si elle apparait dans l'equation.
1.Exprimer le quotient de réaction à l'équilibre correspondant à l'equation de la réaction étudiée.
2.etablir son expression en fonction de la concentration finale en ions oxonium et de la concentration apportée en acide.
voila l'enoncé est un peu long mais les reponse sont plus courte.J'ai essayé de le fair mais je suis pa du tout sur de mes reponses. merci aux personnes qui m'aideront
*** message déplacé ***
salut:
1) voici l'éq. de la réaction étudiée:
RCOOH+H2O = RCOO- + H3O+
2) or:
le tableau d'avancement
RCOOH+H2O = RCOO- + H3O+
CV excès 0 0
cv-x ... x x
=> [H3O+]=[RCOO-] =
[RCOOH]=
=>


