Inscription / Connexion Nouveau Sujet
Calcul d'une quantité de matière
Bonjour je n'arrive plus à partir de la question b. Vous pouvez m'aider svp . C'est un dm de physique chimie à rendre pour demain. Vous êtes ma dernière solution
Merci d'avance et de tout mon coeur.
La soudure aluminothermique permet de relier les rails du chemin de fer entre elles. Elle s'appuie sur: Fe2O3 + 2Al 2 Fe+ Al203
tout est en solide pour l'equation. Je n'ai pas mis de flèche car je n'y arrive pas.
données: M(Fe)=55.8g.mol-1 M(Al)=27.0g.mol-1 M(O)= 16.0g.mol-1
1 On cherche à calculer la masse d'aluminium qui sera nécessaire pour faire réagir 3.00 d'oxyde de fer, initialement présent dans les conditions stoechiométriques Pour cela:
A calculer la quantité de matière initiale d'oxyde fer.
J'ai fait n=m/M
M(Fe2O3)= 55.8*2+16.0*3=159.6g.mol-1
N=3/159.6=0.018mol soit 1.88*10-2mol
B en déduire l'avancement maximale x max
C en déduire la quantité de matière nécessiare d'aluminium pour que la réaction soit totale
D calculer la masse d'aluminium correspondante
2déterminer la masse de chacun des produits
3 le principe de conservation de la masse est-il appliqué?
Re,
On aurait pu continuer sur l'autre sujet mais bon :
1. OK mais je souhaiterais la même qualité rédactionnelle que celle exposée dans l'autre topic.
2. Je t'ai donné des éléments de réponse là-dessus.
J'attends ta proposition de tableau d'avancement.

valeurs en mole avancement Fe_2O_3 + 2Al \rightarrow 2 Fe + Al_2O_3
Etat initaial 0 1,88*10-2 0 0
Etat intermédiaire x 1,88*10-2-x
Etat Final xf 1,88*10-2-xf
après je ne sais pas plus
Comment calculer un avancement maximal de la réaction ?
Que signifie "les réactifs ont été introduits dans des proportions stoechiométriques" ?

Un avancement maximal x max est la valeur de l'avancement correspondant à la disparition totale du réactif en défaut.
Determiner l'avancement maximale: le réactif limitant (en défaut) est le premier à disparaître
soit l'oxyde de fer est en défaut alors ni(Fe2O3)-xmax=0
soit l'aluminium est en défaut alors ni(Al)-2xmax= 0
La plus petite valeurs est celle de x max. Le réactif associé est le réctif limitant.
C'est cela pour l'avancement maximale ?*
L'autre question je ne comprends pas
C'est ça !
Lorsque les réactifs sont introduits dans des proportions stoechiométriques leurs quantités de matières sont nulles à l'état final : ils sont tous deux réactifs limitants.
On peut donc écrire la condition suivante (que tu peux démontrer avec ton tableau d'avancement de la réaction) :
Avec cette condition exprimée, tu es en mesure de calculer les quantités de matière initiales en réactifs (d'où l'indice "i" dans ma formule) et d'en déduire les quantités de matière finales des produits (d'où mon indice "f" dans la formule).
et comment ? avec le tableau d'avancement ? pour avoir les chiffres car on ne connait rien sur l'aluminium
Ayant calculé la quantité de matière initiale en oxyde de fer et ayant exprimé la relation de deux réactifs introduits dans des proportions stoechiométriques, tu peux :
- calculer la quantité de matière initiale en aluminium ;
- calculer la quantité de matière finale en fer ;
- calculer la quantité de matière finale en oxyde d'aluminium.
Et enfin déduire les masses correspondantes, connaissant les masses molaires
Honnêtement t'en dire plus reviendrait à faire l'exercice à ta place 
Je t'ai déjà donné suffisamment d'indications.
Je te demande donc de redémontrer la relation établie lorsque les réactifs sont introduits dans des proportions stoechiométriques :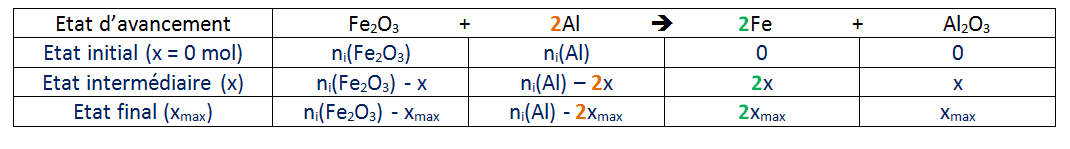
Ayant calculé la quantité de matière initiale en oxyde de fer et ayant exprimé la relation de deux réactifs introduits dans des proportions stoechiométriques, tu peux :
- calculer la quantité de matière initiale en aluminium ;
- calculer la quantité de matière finale en fer ;
- calculer la quantité de matière finale en oxyde d'aluminium.
Et enfin déduire les masses correspondantes, connaissant les masses molaires (pour rappel:
A toi de me prouver que mon effort n'a pas été vain
Oui !
D'après le tableau d'avancement de la réaction :
ni(Fe2O3) =1,88*10-2 = xmax
donc ni(Al) = 2*xmax = 2*1,88*10-2 = 3,76*10-2 mol
et donc mi(Al) = ni(Al)*M(Al) = ... g

3,76*10-2*54= 2,0304g la masse de l'aluminium
pour la qantité de matière final du fer= 3,76*10-2*2/2=0,0376
pour la quantite de matière final de l'oxyde de fer=0,0376*1/2=0,0188
C'est cela ?
Ton premier calcul est faux : la masse molaire de l'aluminium t'es fournie par l'énoncé :
donc mi(Al) = ni(Al)*M(Al) = 3,76*10-2 *27 = ... g
Remarque : ne pas mettre plus de 3 chiffres significatifs au résultat.
Ensuite je t'ai déjà expliqué qu'un résultat sans explication et sans unité ne vaut rien 
Même si la méthode est correcte ...
Je vais me déconnecter pour ce soir.
Pour la fin de l'exercice, améliore ta qualité rédactionnelle :
- on explique son bilan de matière sur la base du tableau d'avancement de la réaction ;
- on fait un calcul littéral en définissant bien les notations employées ;
- on fait l'application numérique et on conclut.
Bonne soirée

fer= 0,0376*55,8=2,09
oxyde de fer= 0,0188*27+16=0,80
Pour la question 3 c quoi le principe de masse ? C'est en rapport avec 3,00 g d'oxyde de fer
Bonjour,
Une fois de plus, tu ne tiens pas compte de mes conseils, tu sembles t'en moquer, tout comme du respect des règles d'ailleurs : pas d'unité aux résultats, pas d'explication sur la démarche suivie ...
D'autre part c'est une honte de m'avoir berné de la sorte : le multi-compte est interdit sur le forum.
Désormais, tu seras exclu(e) tant que tu n'auras pas régularisé ta situation : Matha, phyui, kilo, jumpy ...



