Inscription / Connexion Nouveau Sujet
Calcium
le chlorure de calcium CaCl2et le sulfate de potassium, K2SO4 sont des solides ioniques.
*préciser le nom et les formules des ions constituants ces cristaux?
*Les solutions obtenues en dissolvant chacun de ces solides sont-elles électrolytiques?
* écrire les équations de dissolutions
* expliquez la solvatation d'un des ions en solutions.
Je n'y comprends rien aidez moi
ca: calcium cl: chlorure
K potassium SO4 sulfate
ensuite Cl
donne ion Cl-
S04 donne SO4 2-
K donne K+
Ca donne Ca2+
lorsque l'on dissout un solide ionique on obtient une solution electrolytique
CaCl2 ---->Ca 2+ + 2Cl-
K2SO4 ----> 2K+ + SO4 2-
voila j'espere que sa t'aidera
Salut !
!
Petite précision:
On obtient une solution électrolytique lorsqu'on dissout un cristal, car la dissociation va donner lieu à la formation d'ions... Or les conducteurs dans une solution sont les ions
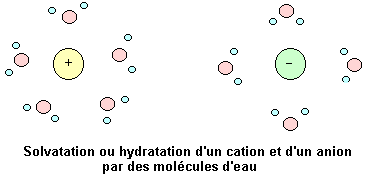
L'eau a pour propriété de détruire les solides ioniques et de disperser les ions. Ces phénomènes s'accompagnent du phénomène de solvatation des ions. Cette solvatation est due au caractère dipolaire de l'eau.
Les cations en solution attirent (interaction électrique) les molécules d'eau par leur partie négative. Il en résulte que chaque cation s'entoure d'un certain nombre de molécules d'eau.
Les anions en solution attirent les molécules d'eau par leur partie positive. Il en résulte que chaque anion s'entoure d'un certain nombre de molécules d'eau.
Ce phénomène est appelé solvatation des ions. Lorsque le solvant est l'eau la solvatation est appelée hydratation.
Les ions hydratés sont notés avec le symbole (aq) en indice. par exemple: Na+(aq) ou Ca2+(aq).
Bonjour à tous !
Moi aussi j'ai le même sujet avec addition de ;
Quelle sont les espèces chimiques présentes dans chacune des solutions supposées non saturées
Merci beaucoup s'il vous plaît une petite idée!
Est ce que les solutions non saturées est celui qui contiennent la charge positive (+)
Comme Ca2+
Bonjour ! Non j'ai pas compris ça
Quelle sont les espèces chimiques présentes dans chacune des solutions supposées non saturées?

 2Ca++2Cl-
2Ca++2Cl-


