Inscription / Connexion Nouveau Sujet
base faible et son acide conjugué
On souhaite étudier le couple acido-basique ion éthylammonium/éthylamine
(C2H5NH3+/ C2H5NH2) noté ensuite BH+/B.
1) Ecrire l'équation-bilan de la réaction de l'eau sur le chlorure d'éthylammonium.
On place dans un bécher un volume Va = 50 mL d'une solution de chlorure
d'éthylammonium de concentration Ca = 4.10-2 mol.L-1
On ajoute à l'aide d'une burette un volume Vb d'une solution aqueuse d'éthylamine de concentration Cb= 10-1 mol.L-1. On
relève à chaque fois le pH.
V (mL) 5 10 15 20 25 30 35
Ph 10,1 10,4 10,5 10,7 10,8 10,9 11
2.1) Tracer la courbe pH =f (log ([B]/[BH+])) et déterminer son équation.
2.2) En déduire la valeur du pKa du couple BH+/B
solution
1) BHCl=>B+(H3O++Cl-)
2)formule
[BH+]=(CaVa)/(Va+Vb)
[B]=(CbVb)/(Va+Vb)
=>log ([B]/[BH+])=log (CbVb/CaVa)
en traçant la courbe normalement ça doit donner une droite non? mais quand je remplie le tableau les valeurs ne coincident pas car je trouve pas le même coefficient directeur quand je prend differentes valeurs
ça me donne :
V (mL) 5 10 15 20 25 30 35
Ph 10,1 10,4 10,5 10,7 10,8 10,9 11
log ([B]/[BH+]) -0.6 -0.3 -0.12 0 1.25 1.76 2.43
pente=(11-10.1)/(2.43+0.6)=0.29#(10.4-10.1)/(-0.3+0.6)=1
Bonsoir
le chlorure d'éthylammonium est un composé ionique totalement soluble dans l'eau à de telles concentrations. La réaction de dissolution disperse dans l'eau des ions chlorure indifférents et des ions éthylammonium. Pour plus de clarté, les ions chlorure ne doivent pas intervenir dans l'équation de la réaction demandée qui est celle des ions éthylammonium sur l'eau :
BH+ + H[/sub]O = B + H[sub]3O+
Ensuite, tu ajoutes de l'éthylamine. Les ions éthalammonium consitutent un acide très faible qui ne réagit quasiment pas sur l'eau donc :
[BH+]=Ca.Va/(Va+Vb)
L'éthylamine versé constitue une base très faible qui ne réagit pratiquement pas ; donc :
[B]=Cb.Vb/(Va+Vb)
Ton raisonnement littéral est correct mais tu as commis une erreur dans le calcul de log([B]/[BH+]) pour les trois dernières valeurs, celles où le logarithme est positif.
Autre remarque : pour tenir compte au mieux de toutes les mesures et éliminer les éventuelles mesures aberrantes, il faut placer les points expérimentaux dans un repère (les croix rouges sur la figure ci-dessous) puis tracer la droite moyenne à la règle, c'est à dire la droite qui passe au plus près des points expérimentaux. C'est l'équation de cette droite moyenne qu'il faut déterminer.
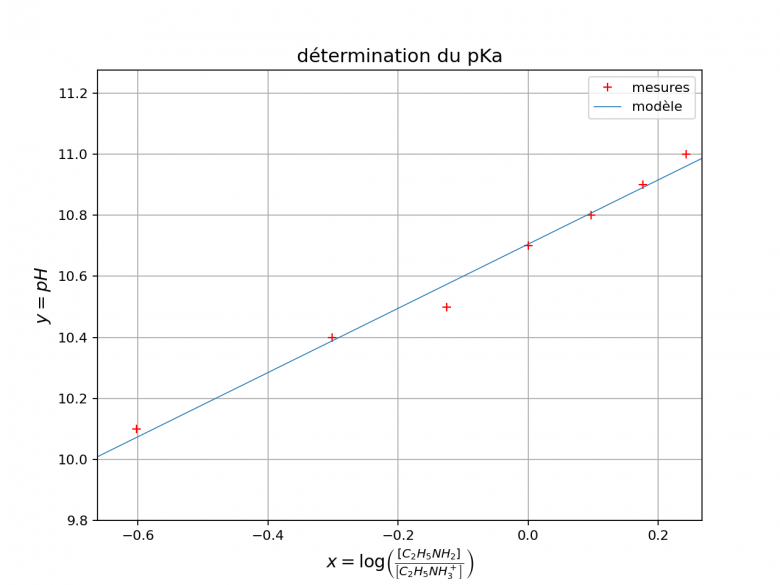
Ah c'est vrai
V (mL) 5 10 15 20 25 30 35
Ph 10,1 10,4 10,5 10,7 10,8 10,9 11
log (/[BH+]) -0.6 -0.3 -0.12 0 0.09 0.17 0.24
pH =f (log ([B]/[BH+])) est une droite donc de la forme
pH=Ax+B avec A=(10.8-10.7)/(0.097-0)=1.0309~1
j'ai pris ces points car quand on trace la droite ce sont les deux points qui sont le plus sur la droite.
le point de coordonnée (0;10.7) verifie l'equation donc on aura
B=10.7
alors pH=x+10.7 or [b]x représente log ([B]/[BH+])
=>pH=log ([B]/[BH+])+10.7
on sait que pH=log ([B]/[BH+])+pKa
par identification pKa =10.7



