Inscription / Connexion Nouveau Sujet
Avancement et concentration
Bonjour
J'ai cet exercice à faire pour mardi et je voudrais savoir si ce que j'ai fait est juste. Merci d'avance
Énoncée:
Toutes les réactions ne progressent pas à la même vitesse. On parle de réactions lentes dans le cas de la réaction de formation de la rouille par exemple. Voici un autre exemple de réaction lente : on mélange V1= 10 mL d'une solution contenant des ions peroxodisulfate S2O82- avec V2=20mL d'une solution contenant des ions iodure I -.
L'équation-bilan correspondant à cette réaction est la suivante :
S2O82- + 2I- ==> 2SO42- + I2.
La courbe ci-dessous traduit l'évolution de la concentration en diiode (notée [I2]) au cours du temps.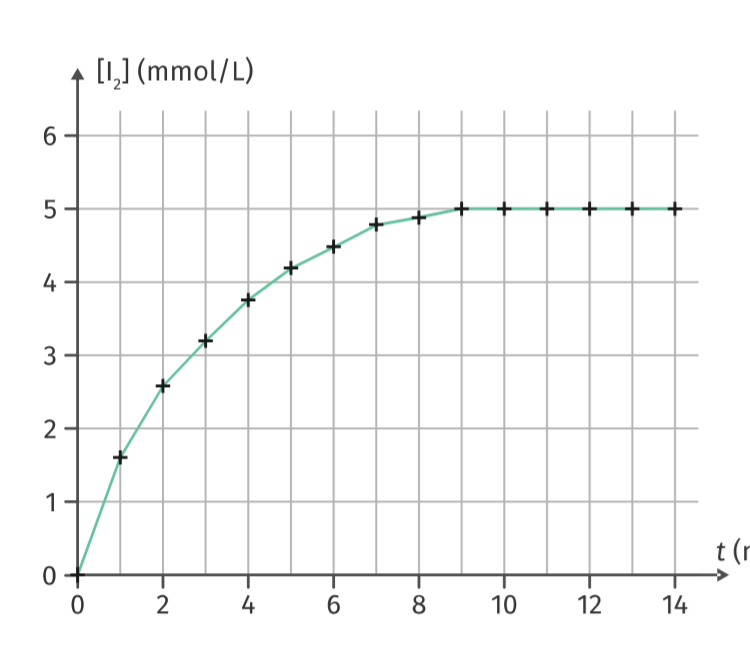
1. Dresser le tableau d'avancement en notant n0 ( S2O82-) et n0 ( I-) les quantités initiales.
2. Déterminer la relation entre [I2] dans le mélange et l'avancement x.
3. En déduire la valeur de l'avancement maximal xmax en utilisant la courbe.
4. Dans le cas où l'ion perixidisulfate S2O82- serait le réactif limitant, quelle devrait être la concentration de la solution de départ contenant ces ions ?
5. Même question avec l'ion d'iodure I-
Réponses :
1.
Équatio(S2O8^2-)- 2I- -> 2SO4^2- +I2
Etat ini x=0 n0(S...). n0(I-). 0. 0
État inter x. n0-x. n0-2x. 2x. x
État final. xmax. n0- xmax. n0-2xmax
=0. =0
2dernieres colonnes 2xmax. xmax
2. La concentration en I2 est égal à x et donc le détermine.
3. Grâce au graphique on peut dire que
xmax= 5mmol
4. A l'etat Final: n0(S...)-xmax=0
n0(S...)= 5 mmol/L
5. A l'etat Final n0(I-)-2xmax =0
n0(I-)=10mmol/L
***Titre corrigé et exposants/indices ajoutés => tu as tous les utilitaires pour le faire la prochaine fois !***
Je suis désolée je me suis trompée sur le titre du topic. Normalement c'est « avancement et concentration »
Bonjour,
Pour rappel, tu as la possibilité de faire proprement des exposants et des indices avec les boutons X2 et X2 en-dessous du cadre dans lequel tu écris.
1. OK, essaie malgré tout de faire un tableau plus lisible la prochaine fois
2. Non, ton tableau d'avancement est exprimé en mol, tu ne peux donc pas écrire qu'une concentration molaire est égale à une quantité de matière ...
Explique davantage ton raisonnement.
3. Faux ! Tu confonds une concentration molaire et une quantité de matière !
4. A reprendre.
5. A reprendre.

Je t'en prie, tu peux rédiger ta solution détaillée pour une vérification si tu le souhaites.
Bon dimanche,

J'ai corrigé, vous pourriez me donner votre avis s'il vous plaît ?
2) La quantité de matière de [I][/2] est égal à la quantité de matière x.
Donc x=m/M=CxV
3) On cherche la valeur d'avancement maximal xmax
xmax= CxV
xmax= 5x0,02
xmax = 0,1 mmol
4) On considère que S2 O82- est le limitant.
n0(S2O82- -xmax=0
n0(S2O82- -0,1=0
n0(S2O82- =0,1 mol
5. On considère que I- est le limitant.
n0(I-)-2xmax =0
n0(I-)-0,2=0
n0(I-)=0,2 mmol
J'ai corrigé, vous pourriez me donner votre avis s'il vous plaît ?
2) La quantité de matière de [I][/2] est égal à la quantité de matière x.
Donc x=m/M=CxV => oui en s'appuyant sur le tableau d'avancement de la réaction réalisé
3) On cherche la valeur d'avancement maximal xmax
xmax= CxV
xmax= 5x0,02 => c'est faux, tu as oublié que le volume du mélange réactionnel est V = V1 + V2 = 30 mL
xmax = 0,1 mmol
4) On considère que S2 O82- est le limitant.
n0(S2O82- -xmax=0
n0(S2O82- -0,1=0
n0(S2O82- =0,1 mol
=> calcul à reprendre avec la bonne valeur pour l'avancement de la réaction mais la démarche est correcte.
Ensuite, que devrait valoir la concentration de la solution initiale ?
Attention à considérer le bon volume à l'état initial

5. On considère que I- est le limitant.
n0(I-)-2xmax =0
n0(I-)-0,2=0
n0(I-)=0,2 mmol
Idem

Pour la 4 et 5 on a
n0(S2O82-) =150 mmol et
4. On considère que le peroxodisulfate est le limitant.
n0(S2O82-) =150 mmol
On cherche la concentration initiale de la solution
C(S2O82-)= n(S2O82-)/V1
C=150/10
C=15mmol/L
5. On considère que l'ion iodure est le limitant.
n0(I-)=300 mmol
C( I-) = n(I-)/V2
C=300/20
C=15mmol/L

Le raisonnement est correct !
Quand on parle d'avancement de la réaction, on est dans le mélange réactionnel : V = V1 + V2.
En revanche, quand on calcule une quantité de matière initiale (ou une concentration molaire), on doit effectivement utiliser le volume de la solution initial.
Je te fais confiance pour les calculs.



