Inscription / Connexion Nouveau Sujet
Anodiser un capot d'aluminium
Bonsoir. Je dois réaliser un exercice de chimie mais j'éprouve quelques difficultés...
Pour anodiser un capot d'aluminium on décape la couche naturelle d'alumine isolante qui le protège sur quelques nanomètres pour la remplacer par une couche régulière qui peut être mille fois plus épaisse et éventuellement teintée. Cette couche est obtenue par décapage et électrolyse.
Le décapage : cette opération consiste en un dégraissage à l'aide d'acétone, suivi d'un lavage avec une solution de soude. Après un rinçage à l'eau, on relave rapidement à l'aide d'une solution d'acide nitrique, puis on rince de nouveau à l'eau. On réalise ensuite une électrolyse dans une solution d'acide sulfurique à 2 mol.L-1. La cathode est une plaque de plomb et l'anode est constituée par le capot en aluminium. Le générateur de tension continue réglable permet de fournir un courant d'intensité I = 250 A.
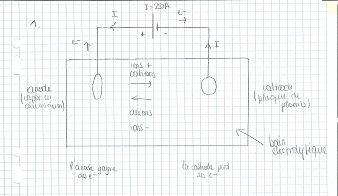
1) Fais le schéma du montage de l'électrolyse en précisant les bornes du générateur et le sens des électrons dans le circuit électrique.
2) Établir l'équation de la réaction d'oxydation de l'aluminium en alumine (Al2O3) ; préciser à quelle électrode elle se réalise (anode ou cathode).
3) On souhaite que la couche d'alumine formée sur le capot de surface totale extérieure S = 2.20 m2, ait une épaisseur finale e = 14.8 x 10-6 m d'épaisseur. En utilisant l'équation de réaction de l'anode, déterminer la durée de l'électrolyse.
Données :
- constante de Faraday F = 9,65 x 104 C . mol-1 ;
- masse volumique de l'alumine  (Al2O3) = 3,2 g . cm-3 ;
(Al2O3) = 3,2 g . cm-3 ;
- masses molaires en g . mol-1 : M(Al) = 27 ; M(O) = 16.
Où j'en suis :
1) 
2) aluminium + dioxygène  alumine
alumine
Al + O2  (Al2O3)
(Al2O3)
4Al + 3O2  (Al2O3)
(Al2O3)
L'oxydation de l'aluminium en alumine se réalise à l'anode
3) M(Al2O3) = 27x2 + 16x3 = 102 g.mol-1
Et après je sais pas comment avancer ... Merci d'avance.
Edit Coll : image placée sur le serveur de l'  Merci d'en faire autant la prochaine fois !
Merci d'en faire autant la prochaine fois ! 
![]()
Bonjour,
Pour essayer de te mettre sur la voie pour la question 3)
on te donne le volume d'alumine que l'on souhaite obtenir. Connaissant la masse volumique et la masse molaire tu peux donc calculer le nombre de moles.
Par ailleurs par l'équation bilan, tu peux associer le nombre de mole d'alumine au nombre de moles d'électron échangés.
Enfin, tu connais l'intensité du courant ... et l'intensité c'est la quantité de charge traversant par seconde une section du circuit ...
Tu as donc tout les éléments pour calculer le temps nécessaire il me semble
On est bon?
Euh ...
Le capot a une surface S et on veut une épaisseur e d'alumine, de là a conclure que le volume est V = S x e ...
Ok donc j'obtiens n = 1.02 x 10-3 mol.
Ensuite comment trouver le nombre de moles d'électrons échangés ?
Moi, j'obtiens pas cela ... (tu as du faire une erreur dans les unités de mesure des volumes ... ou bien moi, ça arrive ... parfois)
Pour continuer, il faut que tu écrive la 1/2 équation redox qui se produit à l'anode afin de déterminer combien de moles d'e- sont échangés par mole de Al2O3 produite ...
En appliquant scrupuleusement la démarche:
1.Rechercher l'oxydant et le réducteur du couple. Écrire l'oxydant à droite et le réducteur à gauche séparés par un signe égal.
2.Equilibrer à l'aide de coefficient les éléments chimiques
3.Ajouter l'élément H2O, si nécessaire
4.Ajouter l'ion H⁺, si nécessaire.
5.Ajouter le ou les électron(s) nécessaire(s) du côté de l'oxydant afin de réaliser la conservation de la charge électrique.
A suivre ...
Je me suis trompée d'unit', j'obtiens n = 0.01 mol.
Donc Q = 0.01 x 9.67 x 104 = 967 C.
 t = Q / I = 967 / 250 = 3,868 secondes.
t = Q / I = 967 / 250 = 3,868 secondes.
Est ce bon? Cette méthode est elle correcte?
Non, je ne pense pas, il faut que tu écrives la 1/2 équation redox pour calculer le nombre d'électrons échangés!



