Inscription / Connexion Nouveau Sujet
alcootest et Oxydoreduction
Bonjour j'ai un exercice a finir pour mercredi, mais j'ai des hésitations sur mes réponses ... voilà l'énoncé:
"Afin de vérifier la présence d'ethanol (=alcool au sens courant du terme) dans l'air expire on emploie les ions dichromatique dans les alcootests : le principe repose sur le changement de couleur du dichrilmate de potassium (orange) lors de sa réaction avec l'éthanol pour donner des ions chrome III de couleur vert.
données : Ox/Red : Ion dichromate / ion chrome III : Cr2O72- / Cr3+
ethanal/ethanol : CH3 - CHO / CH3 - CH2OH
1) Écrire en milieu acide les demi-équations correspondantes à ces 2 couples :
j'ai écris : Cr2O72-+14H+ + 6e- = 2Cr3++7H2O
et l'autre : 3* CH3-CHO+2H++2e- = CH3-CH2OH
2) Écrire l'équation d'oxydation de l'éthanol par les ions dichromatique.
Cr2O72-+14H++CH3-CH2OH --> CH3-CHO+2H++2Cr3++7H2O
3) lors d'un contrôle d'alcoolémie, le conducteur souffle dans un tube d'alcootest contenant n moles de Dichromates de potassium et il en transforme la totalité en ion chrome III. Lorsque son sang contient une concentration massique t en éthanol (g/L), l'air expiré au niveau des poumons en contient une concentration massique 2000 fois plus faible (en g/L aussi ). Le seuil légal pour être déclaré "en état d'ivresse " est de 0.50G/L.
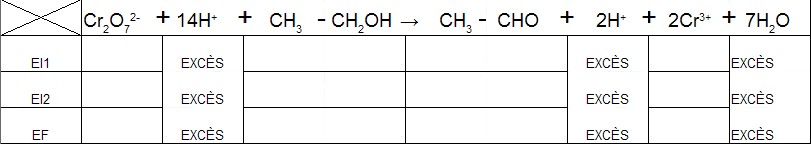
a) Dresser un tableau d'avancement de la réaction ( on appellera nalc la quantité de matière d'alcool expiré par le conducteur.
Pour le tableau j'utilise : Cr2O72-+14H++CH3-CH2OH --> CH3-CHO+2H++2Cr3++7H2O
Les H+ sont en excès et 7H2O aussi.
J'ai un peu de mal avec le tableau, enfin pour les données literral comme nalc que je dois mettre pour Cr2O72- ou CH3-CHO+2H[sup]
2)Déterminer la masse de m de dichromate de potassium qui droit se trouver dans l'alcootest pour être en mesure de détecter la totalité de l'éthanol contenant dans un volume d'air expiré V=200ml (on considère qu'il n y'a pas de pertes et que tout l'éthanol contenu dans l'air expiré entre en réaction avec le dichromate )
J'ai l'impression qu'il manque une donnée  merci d'une aide
merci d'une aide
Edit Coll : image placée sur le serveur de l'  Merci d'en faire autant la prochaine fois !
Merci d'en faire autant la prochaine fois ! 
![]() [lien]
[lien]
je n'ai pas tout lu,mais j'ai noté une erreur au début.
l'équation n'est pas équilibrée.
Tu as bien indiqué qu'il fallait multiplier par 3 la seconde 1/2 équation,mais tu n'en a pas tenu compte dans l'équation globale
Il est fortement recommandé de vérifier la conservation des atomes et des charges dans une équation redox un peu compliquée
je ne vois pas de données manquantes (à part les masses molaires)
calcule la masse d'alcool dans 1 L d'air pour 0,5g/L de sang.
calcule la qté de matière d'alcool dans 200mL d'air
Reporte cette valeur dans le tableau ,comme état initial pour l'alcool.
Pour le dichromate,la qté initiale est n(c'est l'inconnue)
Quel est l'avancement pour le dichromate et l'alcool?


