Inscription / Connexion Nouveau Sujet
activité sur la cinétique
Bonjour, j'aurais besoin d'aide s'il vous plaît.
Je dois faire une activité préparatoire sur la cinétique mais je ne comprend pas...
Voilà les questions :
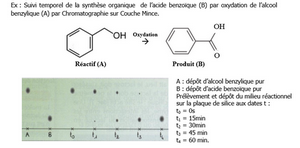
1) Par analyse du chromatogramme, donner un encadrement de la durée de réaction.
2) Classer ces transformations en 2 catégories : réaction lente/rapide
- Formation de rouille par oxydation du métal fer par le dioxygène
- Gonflement d'un airbag par décomposition de l'azoture de sodium
- Décomposition chimique d'un explosif
- Brunissement des fruits par oxydation des phénols par le dioxygène de l'air
3) Proposer une méthode adaptée au suivi de l'évolution de la concentration [I2] en fonction du temps ? Justifiez votre réponse
4) Rappeler la loi qui permet de faire le lien entre la grandeur mesurée au cours du temps et de cette concentration ? Précisez les unités
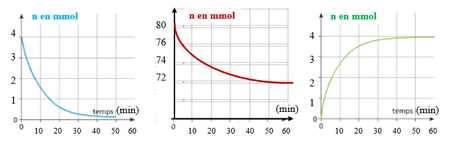
5) Préciser à quelle espèces (S2O82- ; 2 I- ; I2) correspondent chacune des courbes. Justifiez à partir de l'allure des courbes.
6) Donner la composition du milieu réactionnel à la date t= 15 min. En déduire la concentration molaire du diiode formé dans la solution.
n S2O82- =
n I-=
n I2=
n SO42-=
[I2]=
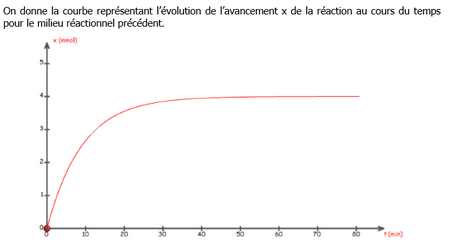
7) A l'aide de la courbe précédente, déterminer graphiquement le temps de démi-réaction.
8) Peut on affirmer qu'après une dure de deux fois t 1/2, la réaction est terminée ?
9) Les ions iodures I- peuvent également être oxydés par l'eau oxygénée H2O2 en milieu acide en diiode I2.
Ecrire l'équation de la réaction sachant que les couples rédox qui interviennent sont les suivants :
H2O2 / H2 O :
I2 / I- :
Je vous remercie d'avance, je vous mets en pièce jointe les différents documents