Inscription / Connexion Nouveau Sujet
acides bases - vrai ou faux et questions
Bonjour,
J'ai du mal à comprendre ce vrai ou faux et les questions qui suivent, pourriez vous m'aider s'ils vous plait?
Voici les propositions :
1. un acide ne peut réagir qu'avec une base plus forte que sa base conjuguée.
(le correctif de cette proposition est : VRAI si la base est plus forte alors l'acide conjugué qui sera produit est plus faible que l'acide engagé comme réactif. On peut donc conclure que delta pKa = pka de l'acide produit - pka de l'acide réactif > 0. Pour que la réaction soit complète, il faut que la valeur de delta pka dépasse 2. ) Ici, je ne comprends pas pourquoi le delta pka > 0 puisqu'on fait qqch de petit - qqch de grand ?
2. A 25°C, le degré d'ionisation de HNO2 (ka = 10^-4) , à pH =, est :
a) 25%
b) 30¨%
c) 40%
d) 50%
e) autre
Alors je sais que le degré d'ionisation = quantité dissociée/quantité dissoute et que c'est toujours compris entre 0 et 1. Mais je n'arrive pas à répondre à la question..
3. L'expression mathématique du degré de dissociation d'un acide faible de concentration Ca est approximativement :
a) a (degré de dissociation) = (Ka/Ca)^1/2
b) a = (Ca/Ka)^1/2
c) a = (Ka/Ca)^2
d) a = (Ka/1-Ca)^2
Voilà, merci beaucoup d'avance !
Question 1:
Si l'acide produit (2) est plus faible que l'acide réactif(1) cela implique que Ka2 < Ka1 donc que pKa2 > pKa1 soit pour reprendre tes termes pas très scientifiques " qqch de grand - qqch de petit "
Question 2:
Enoncé incomplet
Question 3:
Par définition du degré de dissociation : α = [H3O+]eq / Ca
En utilisant un tableau d'avancement on obtient :
[A-]eq = [H3O+]eq = Ca * α et [AH]eq = Ca ( 1- α )
Si en première approximation on néglige α devant 1 et qu'on exprime la constante d'acidité on obtient une relation approchée entre Ka, Ca et α
Bonjour
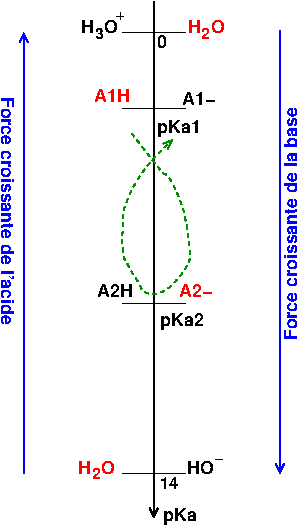
Quelques mots de généralité avant de reprendre les questions de ton exercice. Si on envisage la réaction la plus générale entre un acide A1H et la base conjuguée A2- d'un autre acide A2H, l'équation bilan de la réaction s'écrit :
A1H + A2- = A1- + A2H
Sa constante d'équilibre s'écrit :
En multipliant tous les termes par la concentration en ions oxonium :
L'illustration ci-dessous correspond à un acide A1H plus fort que l'acide A2H, soit :
Ka1>Ka2 ou pKa1<pKa2
Je revient à ta question 1 :
Pour pouvoir répondre OUI à la proposition 1, il faudrait modifier cette proposition :
1. un acide ne peut réagir de façon quasi totale qu'avec une base plus forte que sa base conjuguée. En effet une réaction quasi totale suppose K>>1 donc Ka1>>Ka2 ce qui suppose bien l'acide A1H plus fort que l'acide A2H, donc la base A2- plus forte que la base A1-. Cela est résumé sur le schéma ci-dessous où on voit que la réaction quasi totale respecte la règle du "gamma".
Tette qu'elle est écrite dans ton énoncé, la proposition 1 est fausse. Exemple, l'acide A1H peut très bien réagir sur l'eau selon la réaction :
A1H + H2O = HO- + A1-
Cela correspond par exemple à la réaction de l'acide éthanoïque sur l'eau que tu as sûrement étudiée. Cette réaction existe bien mais elle est très limitée, sa constante d'équilibre est nettement inférieure à 1. Sur le schéma, elle ne respecte pas la règle du "gamma".
Pour 2 : tout dépend de la précision attendue. En général, on considère la réaction comme quasi totale quand sa constante d'équilibre est supérieure à 104. Cela donne :
Un écart de pKa supérieur à 2 suppose une constante K supérieure à 100 ; cela me parait un peu juste pour parler de réaction quasi totale mais, si ton professeur fait cette approximation...
Pour la dissociation de HNO2, les valeurs de Ca et pH sont fournies ?
Pour le degré de dissociation : il s'agit du rapport de la quantité d'acide s'étant transformée en sa base conjuguée sur la quantité d'acide introduite.
Un rapide tableau d'avancement devrait te permettre de conclure...
Bonjour Vanoise,
Pas de problème, bien entendu pour les posts croisés !
J'avais bien noté, moi aussi, que dans l'exercice 1 l'énoncé devait être tronqué soit par son auteur soit par nanaB car dans le "correctif " proposé il est question d'une réaction complète.
Je cite : Pour que la réaction soit complète, il faut que la valeur de delta pka dépasse 2. )
Je ne suis pas certain d'être très présent dans les heures à venir (notamment demain)
N'hésite pas à finir de gérer ce post. Cela ne me pose aucun problème.
Bonsoir,
Je m'excuse, j'ai été vite dans la rédaction de ce post.
Pour la question 2, le pH = 4 et Ka de HNO2 vaut 10^-4 .
Pour ce qui concerne la question 1, je ne comprends toujours pas.. je vais relire encore bien votre message. Je pense que c'est mal reformulé dans mon livre et je me suis un peu embrouillée.
Pour la question 3, j'ai fait le tableau d'avancement mais je n'arrive plus à continuer. Enfin, j'ai la correction de l'exercice devant moi, mais…
J'ai d'abord écrit l'équation :
HA + H2O = A- + H3O+
[] i Ca 0 0
[] r Ca - x +x +x
[] f Ca * x (1-a) a*Co a * Co
C'est justement cette dernière ligne que je ne comprends pas..
Qu e tu prennes la formule que je t'ai donnée ou celle donnée par odbugt1 'elles sont équivallente : on obtient comme tu l'as écrit :
[A-]=[H3O+)= a*Ca puisque x=a*Ca
[AH]=Ca-x=Ca.(1-a)
Il y a bien une erreur dans ton corrigé, au poins tel que tu l'as reproduit ici. Odbugt1 t'avait fournit le résultat...
Pour la question 2, puisque pH=pKa, le résultat est immédiat... Je te laisse réfléchir....
Bonjour,
J'ai réfléchi à toutes ces questions.
Pour la question 1, je pense avoir finalement compris meme si je trouve l'énoncé bizarre.
Pour la question 2, j'ai obtenu aussi la bonne réponse, mais il me reste une question à poser pour ce problème : pour pouvoir résoudre, j'ai du chercher le pka à partir de ka donnée. Mais pourquoi on a besoin de pka?
Pour la question 3, je m'excuse, je ne comprends pas comment on arrive à Co * x (1-a) ..
Merci beaucoup d'avance !
Pour la question 2, puisque pH=pKa, le résultat est immédiat
J'aurais aussi pu écrire : puisque [H3O+] = Ka... Cela revient exactement au même !
je ne comprends pas comment on arrive à Co * x (1-a)
Tu n'as pas bien lu ma dernière réponse : il y a une erreur ; il faut lire : Ca * (1-a) ; "x" n'intervient pas dans cette ligne du tableau d'avancement. Je ne fais pas la différence entre Co et Ca ici... Autant garder une seule de ces deux notations...


