Inscription / Connexion Nouveau Sujet
acide hypochloreux
voilà j'ai un DM de chimie à rendre et je bloque sur quelques questions voici l'énoncé:
1) l'acide hypochloreux a pour formule CIOH. Sa base conjugué CIO- est appelée ion hypochlorite.
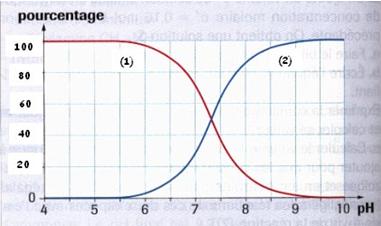
la Figure ci dessous représente les proportions exprimées en pourcentage des formes acide et basique du couple CIOH(aq)/CIO-(aq) en fonction du pH. (voir la photo ci joint)
toute la partie 1 j'ai réussi donc je vous passe les détails mais la partie 2) je bloque:
2) on mélange un volume v1=20mL d'acide hypochloreux de concentration en soluté apporté c= 1.0 10^(-2) mol.L-1 avec un volume v2=10mL d'une solution d'hydroxyde de sodium (Na+ (aq)+HO-(aq)) de concentration en soluté apporté c= 1.0 10^(-2) mol.L-1. Le pH obtenue vaut 7.3.
a) ecrire la reaction de l'acide hypochloreux avec l'ion hydroxyde. ==> ça c'est fait
b) Calculer le rapport ([CIO-](eq))/([CIOH](eq))dans la solution obtenue.
donc là je commence à bloquer je pense mais je suis pas sûr que cela égale à 1 puisque à équivalence ils sont en proportion égale .... ai-je bon?
c) dresser le tableau d'évolution de la transformation chimique qui a lieu lors du mélange des deux solutions. en Utilisant la réponse 2)b) et déterminer l'avancement final. donc je peut pas le faire si je suis pas sûr pour la 2)b) ....
merci de votre aide 
Bonjour et bonne année !!
2)a) ca te donne quoi?
2)b) Est-ce qu'on te donne le pKa du couple? Tu devrais en avoir besoin pour calculer le rapport des concentrations (en écrivant l'expression de Ka...)
2)a) je trouve: CIOH (aq) + HO- = CIO-(aq) + H2O
b) le pka =7.3 on le trouve dans la première partie
je viens de voir tu parle du couple CIOH/CIO- ? ou avec hydroxyde? car le pka que je t'ai donner c'est celui de CIOh/CIO-
Il faut utiliser la valeur du pKa du couple CIOH/CIO- ainsi que de son expression littérale pour calculer le rapport demandé...
pour la 2)b) c'est bon c'est bien =1
maintenant la 2)c) je sais pas les faire les tableaux c'est d'ailleur e qui me plombe lors des DS .....
2b) je trouve aussi rapport=1
2c) il faut que tu fasses un tableau d'avancement avec l'état initial, un état intermédiaire et l'état final...
bon alors j'avais déjà commencer mais la seconde ligne c'est celle la ou je bloque toujours et la dernière aussi:
| HClO(aq) | HO-(aq) | ClO-(aq) | H2O | |
| EI | c*V1=2.0 10-4 | c*V2=1.0 10-4 | 0 | (solvant) |
| Temps t[/sup]? | 1.0 10-4 | 0 ? | 2x= 2.0 10[sup]-4 ? | (solvant) |
| EF | 0 ? | 0 ? | idem que la ligne du dessus en remplacant x par xf ? | (solvant) |
c'est bon??
EI est bon...
pour un temps t il faut écrire : n0-x avec n0 la quantité de matière initiale du constituant. Pour ClO- tu mets "2x" mais pourquoi 2 ? Le nombre stoechiométrique de ce composé est : 1. oK?
L'EF est atteint lorsque un des réactifs (ou les 2) a(ont) disparu(s). oK?
x est déterminé par le réactif limitant...
exemple : dosage de H3O+ par HO-.
Si au départ on a n(H3O+)=2.10-3 moL et n(HO-)=3.10-3 mol.
| H3O+ | HO- | 2H2O | |
| EI | 2.10-3 | 3.10-3 | (solvant) |
| Temps t | 2.10-3 - x | 3.10-3 - x | (solvant) |
| EF | 0 | 1.10-3 | (solvant) |
car le réactif limitant est H3O+ (plus petite quantité de matière) => x=2.10-3 mol
ok?
non non sur la ligne de temps (c'est joliment dit d'ailleurs) tu dois toujours soustraire la quantité de matière initiale du composé par l'avancement x !!! Ce n'est qu'à l'état final que tu peux écire le résultat de cette soustraction...
oui désolé je me suis trompé mais c'est bon j'ai réussi à tout remplir mais la flemme de recopier tout le tableau mais on m'a confirmé qu'il été juste encore merci à toi pour ton aide
maintenant comment je détermine l'avancement final ?
oui à la question suivante en tout cas je te remerci pour ton aide tu m'a aidé a comprendre la méthode ce que mon prof n'a pas réussi à faire  bonne année à toi et encore merci infiniment
bonne année à toi et encore merci infiniment 
Avec plaisir, mais essaie de faire un exo avec des réactifs ayant des coeff stoechiométriques différents de 1 : exemple : 2Al + 3O2 = Al2O3 avec des quantités de matière quelconque...

 V1
V1
