Inscription / Connexion Nouveau Sujet
Acide fort -Base forte
Partie B:
2-3 Une solution aqueuse d'un monoacide noté AH de concentration molaire
C=7.9.03mol.L a un pH =2.1.
Ecrire alors l 'équation-bilan de sa réaction avec l'eau en justifiant.
On prépare une solution en dissolvant une masse m du monoacide AH de masse molaire M
dans un volume V d'eau pure. On négligera la variation de volume consécutive à la dissolution
de l'acide.
Exprimer le pH de la solution en fonction de m.Met V. (0,5 pt)
2-5 On mesure les pH de plusieurs solutions obtenues chacune par dissolution d'une masse m
de cet acide dans un volume V =1L d'eau.
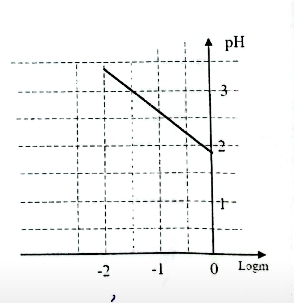
Le graphe pH = f(logm)est reproduit ci-dessous
a)Montrer. à partir du graphe. que le pH peut se mettre sous la forme:
pH= a log(m)+b où a et b sont des constantes dont on
déterminera les valeurs.
b) Déduire des résultats précédents la masse molaire M
de l'acide et l'identifier parmi les acides de formules:
HCl ; HNO3; H2SO4 ; HClO3.
2
Données:masses molaires en g.mol':M(H)=1:M(O)
=16:M(S)=32:M(N)=14:M(C1)=35.5
On prélève un volume Va=20mL d'une des solutions de l'acide de pH =2.1 et on y ajoute un volume Va=30mL d'une solution d'hydroxyde sodium de concentration
molaire Cb=5.10-2mol.L-1.
Bonsoir
Commence par la question 2.3. Tu peux écrire l'équation de la réaction sur l'eau, remplir un tableau d'avancement et vérifier que le pH mesuré correspond bien à un acide fort. J'imagine que la question 2.4 consiste à obtenir l'expression littérale qui correspond à la généralisation de 2.3.
Ensuite : tu sais sûrement obtenir l'équation d'une droite...
Je te laisse réfléchir et faire des propositions de solution. Pose des questions précises sur ce que tu ne comprends pas.