Inscription / Connexion Nouveau Sujet
Acide base
Bonjour à tous et bonne année 2017
Alors j'ai dans 100ml de solution de pH=2.5 et le pKa=2.
Quelle quantité de en mg y a-t-il dans cette solution ?
J'ai essayé avec ce chemin:
et
d'ou :
=
Je suis pas sûre de mon résultat et du mode opératoire merci d'avance pour vos indications. 
Hello
Très bonne Année à toi également
Juste quelques remarques, dans ton enchainement d'égalité, tu mets en oeuvre un certain nombre de règles qu'il n'est pas, à mon humble avis, inutile de rappeler "systématiquement" (dans la rédaction de la solution) afin de s'assurer que l'on a bien le droit de les appliquer:
1) conservation de la matière:
2) électroneutralité:
3) ph = 2.5:
Mais bien sûr tu sais cela parfaitement 
PS: également, si la question posée est réellement
Quelle quantité d'ions
la réponse est

La question exacte est:
Quelle quantité (en mg) de y a-t-il dans 100mL de solution sachant que le pH=2.5?
On donne
Vu qu'on donne le couple je me suis dit que la réaction était
Au début j'étais passé par
Mais pourquoi mon premier calcul est faux?
Hello
Désolé pour la confusion, ma "bible" (cf ci-dessous) indique un pKA de 2 pour le couple
On va donc supposer pKa = 2 pour le couple
L'électroneutralité s'écrit alors:
Si on pose
alors
Numériquement je trouve
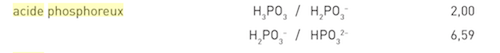
Je comprends que l'équation d'électroneutralité s'écrit ainsi mais pour la suite je ne comprends pas trop pourrais tu m'expliquer le raisonnement? 
Merci
Hello
ourrais tu m'expliquer le raisonnement?
Je reprends
On pose
Conservation de la matière:
donc
Electroneutralité:
donc
Avec
Donc on retrouve bien
(1)
L'équilibre des réactions acido basique nous dit également
Soit (2)
Et pourquoi n'arrive t'on pas au même résultat?
parce que dans l'hypothèse où le couple acido/basique mis en jeu était
l'électroneutralité s'écrivait
mais l'énoncé indiquait que le couple acido/basique mis en jeu est :
l'électroneutralité s'écrit donc :
Ce qui n'est pas du tout la même chose
C'est bon?
Désolée Dirac mais je connecte pas tout à fait
J'essaye de comprendre :
Conservation de la matière:

Equation d'électrneutralité: avec OH- négligeable
Donc
Jusque là ça va mais après je ne comprends comment fais tu pour trouver Co-x.
Merci de ta patience
Euh ...
On développe
On simplifie
C'est l'équation (1)
L'équilibre acido/basique c'est
(2)
D'après (2)
Donc
On injecte dans (1)
Donc
On a bon?
Euh ....
Donc x=
Non,
C'est ok pour toi comme ça il me semble qu'il y avait une petite erreur sur
Non plus, je ne commets jamais d'erreur
 ... enfin si quelques fois
... enfin si quelques fois  , même souvent me dit on ...
, même souvent me dit on ... 
Peux tu préciser?
Je m'embrouille toute seule
On repart de Co
On l'injecte dans
Ok j'ai compris mon erreur.
Merci beaucoup pour cet échange et pour ta patience Dirac. Je te souhaite une belle soirée et à bientôt 
euh ... a bientôt ... là il faut que je me repose 
Pas de soucis, pour te rassurer, une statistique récente du MIT rapporte que dans les universités américaines, la probabilité d'erreur lorsque l'étudiant(e) passe d'une ligne de calcul à une autre était de 56%, je te laisse estimer la probabilité de succès après 4 lignes de calcul ... 
Merci mon sommeil sera beaucoup plus reposant , la pratique est ma seule arme donc je m'y remet
, la pratique est ma seule arme donc je m'y remet 
Repose toi bien....
Bon ben on va reprendre celui là également ...
Le couple acido basique en jeu est finalement
H2PO3 / HPO3- (pKa = 2,00)
acide phosphoreux / ion hydrogénophosphorite
(PROMIS JE VAIS LIRE LES ENONCES SERIEUSEMENT DESORMAIS ...)
Je reviens à mes égalités "fétiches":
conservation de la matière :
électroneutralité:
équilibre:
pH = 2,5 donc [OH^-] << [H^+]
donc
Donc
Arrivée là:
1) tu es très contente car cet exactement ce que tu proposais dès le début 
2) tu n'es pas contente pour tout ce temps perdu ... (je bats ma coulpe à nouveau et suis sincèrement désolé de t'avoir embrouillé avec

3) mais tu es désespérée car le corrigé dont tu disposes annonce

Le correcteur de l'exercice utilise pour trouver ce résultat
Ce qui est un problème ... car comment peut on avoir
Avec
Bon , je me suis déjà bien planté aujourd'hui donc avant d'annoncer le score
AHL1700 : 1 / CORRIGE : 0 (DIRAC a -10 de toute façon!)
Je vais aller promener les chiens et attendre des commentaires éclairés


