Inscription / Connexion Nouveau Sujet
acide-base
Bonjour .
1.J'aimerais savoir comment évolue le pH d'une solution dans laquelle on ajoute une quantité non négligeable d'un composé ayant un pKa 5.
5.
2. Même question sauf que pKa 14.
14.
merci d'avance .
Le pKa est une caractéristique d'un couple acide/base.
Une solution d'un composé de pKa 5 peut contenir majoritairement la forme acide ou basique.
Elle peut aussi être constituée d'un mélange de la forme acide et basique où aucune des deux espèces n'est prépondérante.
Un cas particulier est celui où les proportions de formes acide et basique sont voisines .Dans ce cas on a affaire à un tampon.(l'effet tampon est maximal si [base]=[acide]).
On ne peut donc pas apporter une réponse précise aux questions ,telles qu'elles sont posées.
(bonjour ,shadomiko.Ma réponse était en stand by suite à un très long coup de fil)
a ok . je vous met la consigne entière alors :
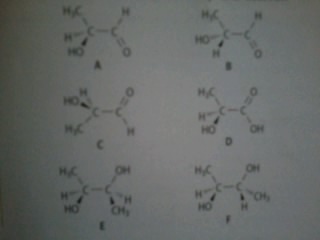
Les molécules organiques contiennent toutes des atomes de carbone. On en donne quelques exemples ci-dessous.
1. Dans cette question il fallait dire si entre chaque molécule elles étaient identique , énantiomère , diastéréoisomère ou non isomère .
2. Quels groupes d'atomes caractéristiques reconnaît-on dans ces molécules?
3. Comment évolue le pH d'une solution dans laquelle on ajoute une quantité non négligeable de composé D ?
4. Même question pour le composé E.
Données.Pour un couple alcool/ion alcoolate, pKa 14 ; pour un couple acide carboxylique/ion carboxylate: pKa
14 ; pour un couple acide carboxylique/ion carboxylate: pKa 5.
5.

 !
!

