Inscription / Connexion Nouveau Sujet
à la recherche de la composition à l'état final
Bonsoir, pourriez vous m'aider à comprendre et à faire cet exo de chimie?
On considère la réaction entre le dihydrogène et le dioxygène qui produit de l'eau.
1)Ecrire l'équation de cette réaction.
2)Dresser le tableau d'avancement dans le cas général.
3)On fait réagir une mole de dioxygène avec une mole de dihydrogène.
a)Quelle est la valeur de l'avancement maximal?
b)Quel est le réactif limitant?
c)Quelle est la composition de l'état final?
pour la 1) j'ai fait 2H2+O2=H2O
pour la 2) que veut dire "dans le cas général"? que faire?
la 3)c).. que signifie cette question concrètement?
merci d'avance
Salut Romane (encore !  )
)
1. Ton équation n'est pas équilibrée ...
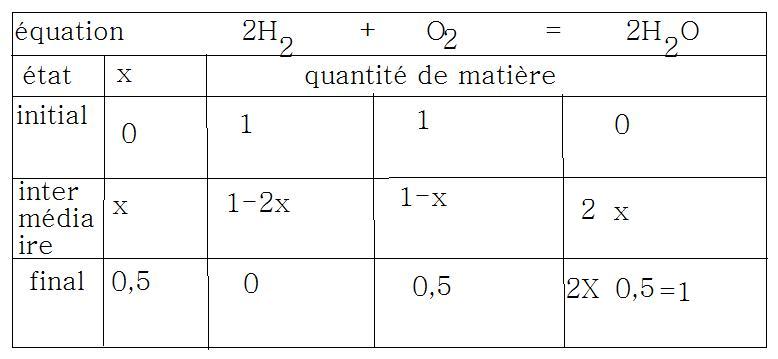
2H2 + O2 = 2H2O
2. Tu fais un tableau classique
état / équation
initial
intermédiaire
final
3. Tu connais l'état initial
ni(O2) = 1 mol
ni(H2) = 1 mol
A l'état maximal, tous les réactifs ont réagi leurs quantités de matière ont réagi :
ni(O2) - xmax = 0
ni(H2) - 2xmax = 0
On prend la + petit des xmax soit xmax = .......
Le réactif limitant est donc .....
Bilan de matière : il reste ..... et il se forme .....
Il faut que tu essaies de faire les exos toi-même pour progresser.
Je t'ai guidé, à toi de jouer 
je passe longtemps dessus avant de les poster.. mais là avec les vacances.. bref il faut que je réactive vite tout ce que je faisais sans problème avant..
1) Oui j'ai oublié d'écrire le 2.. inatention
2) comment remplir les cases si on a pas la quantité de matière initiale?
thanks
3. Tu connais l'état initial
ni(O2) = 1 mol
ni(H2) = 1 mol
Lis bien ce que j'ai fait

mais là avec les vacances.. bref il faut que je réactive vite tout ce que je faisais sans problème avant..
en effet

C'est pareil pour tout le monde

j'imagine 
en fait c'est pour la 2) "dans le cas général", cad faire le tableau sans valeurs..?
3)a)l'avancement maximal xmax = 0,5mol
b)Le réactif limitant est le dihydrogène.
c)La composition de l'état final? il faut faire un bilan? 1 mol d'eau a été créé, il reste 0,5mol de dioxygène..
est ce juste?
thanks