Inscription / Connexion Nouveau Sujet
valider une equation par mesure de pression
Bonjour, j'ai une problème avec mon TP de chimie :
Le sujet est sur l'image ci-joint.
La question est : En dressant un tableau descriptif de l'évolution du système, montrer que l'équation proposée dans les données permet de justifier la valeur de la pression finale obtenue expérimentalement.
Ce que j'ai fait :
Après avoir calculé les quantités de matières de l'hydrogène et du magnésium et fait le tableau d'avancement en m'aidant de l'équation donnée dans l'énoncé. J'ai déterminé que le réactif limitant est l'hydrogène. Les produits sont donc 5,00.10^-3 mol.
Puis je bloque... Je pense qu'il faut utiliser la loi des gaz parfait mais je ne vois pas comment l'utiliser dans ce cas. Le résultat que je trouve est faux. Peut-être est-ce une erreur de calcul dans le tableau ?
Je vous remercie d'avance pour vos précieuses réponses.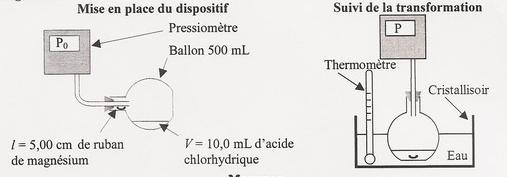
édit Océane : si tu veux de l'aide, merci de faire l'effort de recopier ton énoncé sur le forum 
Les données sont les suivantes :
Pression initiale : Po = 1016hPa Pression finale : Pf = 1128hPa
Température du système chimique : T = 19,5°C
Masse de 1m de ruban de magnésium : m = 1,45g
Volume total du système chimique (air + solution) : V = 596mL
Les données sont les suivantes :
-La solution aqueuse d'acide chlorhydrique contient des ions H+ et Cl- dissous dans l'eau
Une concentration C = 1,00 mol.L-1 signifie que dans un litre de solution, il y a 1,00mol.L-1 de H+ et 1,00mol.L-1 de Cl-
-On suppose que le gaz produit lors de la transformation est du dihydrogène h2. Pour modéliser la transformation, on propose l'équation suivante :
2H+ + Mg -----> H2 + Mg2+
- la constante des gaz parfait est 8,31
-la masse molaire du magnésium est M(mg) = 24,3 g.mol-1
En dressant un tableau descriptif de l'évolution du système, montrer que l'équation proposée dans les données permet de justifier la valeur de la pression finale obtenue expérimentalement.
Après avoir fait un tableau d'avancement, je trouve 5,00.10^-3mol comme réactif limitant.
l'augmentation de pression est due à l'augmentation Delta n du nombre de mole de gaz.
D'après la loi des Gaz Parfait, on a :
DELTA (P) x V = DELTA (n) x RT
Donc DELTA (P) = (DELTA (n) x RT)/V
Sachant que Delta (n) = 5,00.10^-3 mol.
V= 5,96.10^-4 mètre cube. (c'est la que j'ai un doute ???????)
DELTA (n) = 5,0.10^-3
T = 292,5 K.
Mais je ne trouve pas la bonne pression finale...
Je vous remercie d'avance.


