Inscription / Connexion Nouveau Sujet
Un médicament contre l'anémie
A. Un médicament, contenant des ions fer (II) Fe2+, se présente sous la forme de comprimés. On cherche à vérifier la teneur en ion fer (II) en effectuant un dosage spectrophotométrique.
En présence d'une solution incolore d'o-phénanthroline, les ions Fe2+ (aq) réagissent avec apparition d'une coloration rouge.
La concentration effective des ions Fe2+ (aq) de cette solution peut alors être déterminée par la mesure de l'absorbance de la solution pour une longueur d'onde de 500 nm.
1. Pourquoi choisir une longueur d'onde = 500 nm?
2. Pourquoi la solution d'o-phénanthroline doit-elle être introduite en excès par rapport aux ions fer (II)?
B. On écrase un comprimé du médicament dans un mortier. La totalité du comprimé est introduite dans une fiole jaugée de 1000 mL.
On complète avec de l'eau distillée et on agite longuement la solution. La solution S0 obtenue est incolore.
Dansune fiole de 50,0 mL, on verse 5,0 mL de S0, puis on ajoute de l'o-phénantroline dans les mêmes proportions que celles utilisées pour préparer l'échelle de teinte.
La fiole est complétée avec de l'eau distillée : soit S'0 la solution obtenue.
L'absorbance de la solution S'0, pour = 500 nm, est égale à A' = 1,45.
4. Déterminer la concentration massique t0 en ion Fe2+ (aq) dans la solutin S'0. En déduire la concentration massique t0 en ion Fe2+ (aq) dans la solution S0.
5. Calculer la masse d'ions Fe2+ (aq) contenue dans un comprimé.
6. D'après la notice, la masse de "sulfate ferreux sesquihydraté" dans un comprimé est de 256,30 mg alors que la masse d'ions Fe2+ est de 80 mg.
En notant FeSO4, nH2O la formule du sulfate ferreux sesquihydraté, montrer que n = 1,5."
J'aurais vraiment besoin d'aide pour cet exercice, je suis vraiment nul
Bonsoir,
Je vais essayer de faire l'exercice. Cependant, je ne suis qu'en première, et il se peut que je me trompe.
1) Il faut choisir la longueur d'onde 500 nm parce que cette longueur d'onde correspond à la lumière verte. Or, les ions Fe2+ réagissent en colorant la solution en rouge. La solution absorbe donc les radiations correspondantes à la couleur complémentaire de celles qu'elle émet (dont la synthèse additive est le rouge). Ainsi, son maximum d'absorption devrait être la radiation correspondant à la lumière verte, à savoir 500 nm.
2) Nous savons que la réaction entre les ions Fe2+ et l'o-phénantroline colore la solution en rouge. Si l'o-phénantroline est le réactif limitant, alors il restera des ions Fe2+ dans la solution. Nous ne pourrons pas savoir combien, et nous ne pourrons donc pas aboutir aux résultats de l'expérience, puisqu'il sera impossible d'avoir des valeurs correctes lors de la spectrophotométrie.
Au contraire, si l'o-phénantroline est introduite en excès, il n'y aura plus d'ions Fe2+ dans la solution, mais il restera de l'o-phénantroline. Cela n'est pas gênant, compte tenu du fait que cette espèce chimique est incolore. Ainsi, la solution sera la plus rouge possible, et les valeurs trouvées lors de la spectrophotométrie pourront être prises en compte, tous les ions Fe2+ étant alors "visibles".
Je le répète, je peux me tromper...
En espérant vous avoir aidé pour le début,
Cordialement,
qallouet.
Par contre, j'ai beau chercher la réponse aux questions suivantes, je n'y arrive pas...
Ne manquerait-il pas une donnée ? Ou une courbe montrant l'absorbance en fonction de la concentration ?
En effet, s'il y a une courbe, c'est possible.
S'il n'y a pas de courbe, mais que l'on connait le coefficient directeur de la droite de l'absorbance en fonction de la concentration, c'est possible.
Si nous avons la largeur de la cuve, et le coefficient d'absorption molaire, c'est possible.
Mais nous n'avons aucune de ses trois données. Ainsi, je ne vois vraiment pas comment répondre aux questions suivantes... Je suis désolé !
Cordialement,
qallouet.
A. Un médicament, contenant des ions fer (II) Fe2+, se présente sous la forme de comprimés. On cherche à vérifier la teneur en ion fer (II) en effectuant un dosage spectrophotométrique.
En présence d'une solution incolore d'o-phénanthroline, les ions Fe2+ (aq) réagissent avec apparition d'une coloration rouge.
La concentration effective des ions Fe2+ (aq) de cette solution peut alors être déterminée par la mesure de l'absorbance de la solution pour une longueur d'onde de 500 nm.
1. Pourquoi choisir une longueur d'onde = 500 nm?
2. Pourquoi la solution d'o-phénanthroline doit-elle être introduite en excès par rapport aux ions fer (II)?
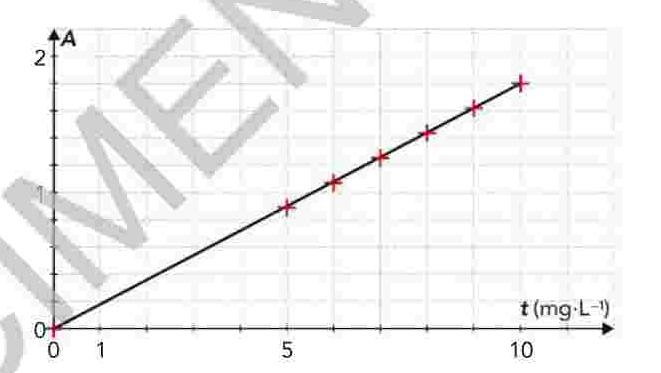
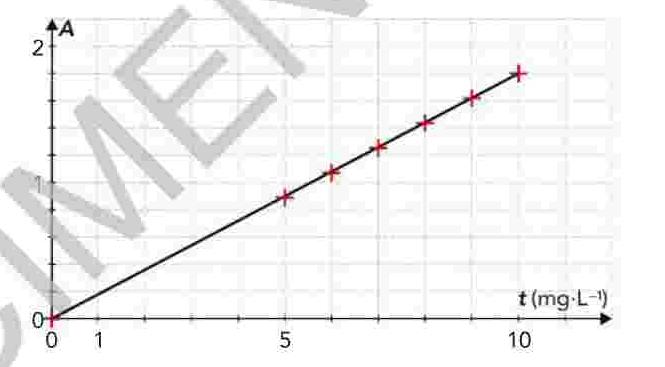
3.en exploitant ce graphe, établir la relation numérique entre les grandeurs A et t , en précisant les unités.
à partir d'une solution S de concentration massique t=20,0*10-3g.L-1en ions fer III et en présence d'o-phénanthroline, on réalise une échelle de teinte. Le graphe donnant l'évolution de l'absorbance A en fonction de concentration massique t en ions fe2+(aq) est donné ci-dessous
B. On écrase un comprimé du médicament dans un mortier. La totalité du comprimé est introduite dans une fiole jaugée de 1000 mL.
On complète avec de l'eau distillée et on agite longuement la solution. La solution S0 obtenue est incolore.
Dansune fiole de 50,0 mL, on verse 5,0 mL de S0, puis on ajoute de l'o-phénantroline dans les mêmes proportions que celles utilisées pour préparer l'échelle de teinte.
La fiole est complétée avec de l'eau distillée : soit S'0 la solution obtenue.
L'absorbance de la solution S'0, pour = 500 nm, est égale à A' = 1,45.
4. Déterminer la concentration massique t0 en ion Fe2+ (aq) dans la solutin S'0. En déduire la concentration massique t0 en ion Fe2+ (aq) dans la solution S0.
5. Calculer la masse d'ions Fe2+ (aq) contenue dans un comprimé.
6. D'après la notice, la masse de "sulfate ferreux sesquihydraté" dans un comprimé est de 256,30 mg alors que la masse d'ions Fe2+ est de 80 mg.
En notant FeSO4, nH2O la formule du sulfate ferreux sesquihydraté, montrer que n = 1,5."
J'aurais vraiment besoin d'aide pour cet exercice, je suis vraiment nul
*** message déplacé ***
svp aidez moi je doit rendre cette exercice demain et je n'arrive pas à le faire
Merciii...
*** message déplacé ***
A. Un médicament, contenant des ions fer (II) Fe2+, se présente sous la forme de comprimés. On cherche à vérifier la teneur en ion fer (II) en effectuant un dosage spectrophotométrique.
En présence d'une solution incolore d'o-phénanthroline, les ions Fe2+ (aq) réagissent avec apparition d'une coloration rouge.
La concentration effective des ions Fe2+ (aq) de cette solution peut alors être déterminée par la mesure de l'absorbance de la solution pour une longueur d'onde de 500 nm.
1. Pourquoi choisir une longueur d'onde = 500 nm?
2. Pourquoi la solution d'o-phénanthroline doit-elle être introduite en excès par rapport aux ions fer (II)?
3.en exploitant ce graphe, établir la relation numérique entre les grandeurs A et t , en précisant les unités.
à partir d'une solution S de concentration massique t=20,0*10-3g.L-1en ions fer III et en présence d'o-phénanthroline, on réalise une échelle de teinte. Le graphe donnant l'évolution de l'absorbance A en fonction de concentration massique t en ions fe2+(aq) est donné ci-dessous
B. On écrase un comprimé du médicament dans un mortier. La totalité du comprimé est introduite dans une fiole jaugée de 1000 mL.
On complète avec de l'eau distillée et on agite longuement la solution. La solution S0 obtenue est incolore.
Dansune fiole de 50,0 mL, on verse 5,0 mL de S0, puis on ajoute de l'o-phénantroline dans les mêmes proportions que celles utilisées pour préparer l'échelle de teinte.
La fiole est complétée avec de l'eau distillée : soit S'0 la solution obtenue.
L'absorbance de la solution S'0, pour = 500 nm, est égale à A' = 1,45.
4. Déterminer la concentration massique t0 en ion Fe2+ (aq) dans la solutin S'0. En déduire la concentration massique t0 en ion Fe2+ (aq) dans la solution S0.
5. Calculer la masse d'ions Fe2+ (aq) contenue dans un comprimé.
6. D'après la notice, la masse de "sulfate ferreux sesquihydraté" dans un comprimé est de 256,30 mg alors que la masse d'ions Fe2+ est de 80 mg.
En notant FeSO4, nH2O la formule du sulfate ferreux sesquihydraté, montrer que n = 1,5."
J'aurais vraiment besoin d'aide pour cet exercice, je suis vraiment nul
*** message déplacé ***
1) Il faut choisir la longueur d'onde 500 nm parce que cette longueur d'onde correspond à la lumière verte. Or, les ions Fe2+ réagissent en colorant la solution en rouge. La solution absorbe donc les radiations correspondantes à la couleur complémentaire de celles qu'elle émet (dont la synthèse additive est le rouge). Ainsi, son maximum d'absorption devrait être la radiation correspondant à la lumière verte, à savoir 500 nm.
2) Nous savons que la réaction entre les ions Fe2+ et l'o-phénantroline colore la solution en rouge. Si l'o-phénantroline est le réactif limitant, alors il restera des ions Fe2+ dans la solution. Nous ne pourrons pas savoir combien, et nous ne pourrons donc pas aboutir aux résultats de l'expérience, puisqu'il sera impossible d'avoir des valeurs correctes lors de la spectrophotométrie.
Au contraire, si l'o-phénantroline est introduite en excès, il n'y aura plus d'ions Fe2+ dans la solution, mais il restera de l'o-phénantroline. Cela n'est pas gênant, compte tenu du fait que cette espèce chimique est incolore. Ainsi, la solution sera la plus rouge possible, et les valeurs trouvées lors de la spectrophotométrie pourront être prises en compte, tous les ions Fe2+ étant alors "visibles".
j'ai fait juste les deux premieres questions j'y arrive pas pour la suite
*** message déplacé ***